طاقة التأين Ionization Energy
- طاقة التأين هي أدني طاقة تكفي لانتزاع إلكترون من الذرة في وضعها المستقر وحالتها الغازية.
- أو هى مقدار الطاقة بالكيلوجول اللازمة لنزع مول واحد من الألكترونات من مول واحد من الذرات الغازية.
- وحدة قياس طاقة التأين kJ/mol
- وقد خصصت الذرات الغازية فى هذا التعريف لأنه من المفترض أن الذرة في الطور الغازي لا تتأثر بمجاوراتها ولذلك فلا وجود للقوى بين الجزيئية (أى قوى ما بين الجزيئات intermolecular forces) لتؤخذ فى الحسبان عند قياس طاقة التأين.
- إن مقدار طاقة التأين هو مقياس لشدة تمسك الذرة بالإلكترون فكلما ازدادت طاقة التأين أصبحت إزالة الإلكترون أكثر صعوبة.
- عملية التأين هي دائماً ماصة للحرارة endothermic وقد اصطلح على أن تكون الطاقة الممتصة من قبل الذرات (أو الأيونات) في أثناء عملية التأين موجبة، وهكذا فإن طاقات التأين جميعها مقادير موجبة.
- جهد التأين موجب دائما ً لأنه هو الطاقة اللازمة لانتزاع إلكترون من الذرة أى أن الذرة تحتاج لطاقة لكى يحدث هذا الأنتزاع أى أن هذة العملية ماصة للحرارة وعلى ذلك فأن طاقة التأين هنا موجبة دائماً.
الميل الإلكتروني (الألفة الإلكترونية ) Electron Affinity
- الميل الألكتروني هو مقدار الطاقة المنطلقة من الذرة المفردة وهي في حالتها الغازية عندما تكتسب إلكتروناً مكونةً أيوناً سالباً.

- الذرة تكتسب إلكترون أو أكثر حتى يصبح عدد الإلكترونات فى مستوى الطاقة الخارجى ثمانية إلكترونات . وتكون الذرة أكثر إستقرارا.
- يقاس الميل الألكترونى بوحدة الطاقة ( إلكترون فولت eV).
- العملية العكسية للميل الألكتروني هي طاقة التأين (جهد التأين).
- الكلور له أعلى ميل الكتروني بين العناصر حيث يعتبر الكلور أقوى العناصر التي يمكن أن تقوم بالهجوم على الإلكترونات واقتناصها بينما الرادون أضعفها.
- الميل الألكتروني لللافلزات أكبر من الفلزات. كما أن الغازات النبيلة تعتبر استثناء حيث تكون قيمة الميل الألكتروني لها موجبة.
- الميل الإلكتروني للغازات النبيلة قليل جدا ويكون موجب لأن مستوى الطاقة الخارجي لها مكتمل . وإذا أرغمت على إكتساب إلكترون يكون ذلك بامتصاصها كمية طاقة كبيرة . ولكن لا تلبث أن تفقد هذا الإلكترون لأنها تكون غير مستقرة فى هذه الحالة.
- الميل الألكترونى لا يكون للعناصر وحسب بل يمتد ليشمل الجزئيات أيضا فالميل الألكتروني للبنزين موجب والميل الالكتروني للهيكسا سيانو بنزين يفوق الفلور.
- الميل الإلكتروني يساوى (50-) للانثانيدات . ويساوى صفر للأكتينيدات.
- تكون قيمة الميل الالكتروني أصغر مايمكن عندما تكون العناصر مستقره وإذا دخل عليها أي إلكترون يخرجها من هذا الاستقرار فمثلاً العناصر الخاملة أو النبيلة يكون الميل الألكترونى بها أقل مايمكن نظرا لنظامها الألكترونى المستقر.
إشارة قيم جهد التأين دائماً موجبة
- من المعروف أنه فى حالة امتصاص طاقة بواسطة نظام ما فأن علامة هذة الطاقة موجبة أما عند انطلاق الطاقة من هذا النظام فإن علامتها تكون سالبة.
- جهد التأين موجب دائما ً لأنه هو الطاقة اللازمة (الممتصة) لانتزاع إلكترون من الذرة أى أن الذرة تحتاج لطاقة لكى يحدث هذا الأنتزاع أى أن هذة العملية ماصة للحرارة وعلى ذلك فأن طاقة التأين هنا موجبة دائماً.
- عملية التأين هي دائماً ماصة للحرارة endothermic وقد اصطلح على أن تكون الطاقة الممتصة من قبل الذرات (أو الأيونات) في أثناء عملية التأين موجبة، وهكذا فإن طاقات التأين جميعها مقادير موجبة.
إشارة قيم الميل الإلكتروني سالبة أو موجبة
- تكون قيم الميل الالكتروني كبيرة عندما يعمل الإلكترون المكتسب على ملء مستوى الطاقة الأخير أو يجعل مستوى الطاقة الفرعي ممتلئ أو نصف ممتلئ.
- بعض العناصر لها ميل إلكتروني موجب، والبعض الآخر له ميل إلكتروني سالب. إذن بالنسبة لبعض العناصر، إضافة إلكترون إلى ذراتها الغازية عملية طاردة للحرارة، وبالنسبة للبعض الآخر عملية ماصة للحرارة.
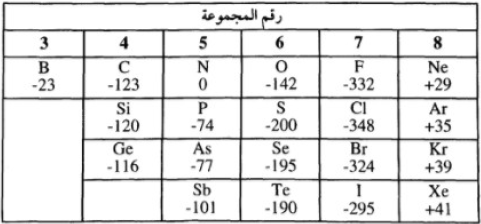
- تتوقف إشارة طاقة الميل الإلكتروني على مدى ثبات الأيون السالب الناتج حيث يكون:
(أ) عندما يكون الميل الإلكتروني كبير وسالب فأنه يدل على أن الأيون السالب عالي الثبات (أى أن للذرة ميلاً كبيراً لإكتساب إلكترون) تماماً مثلما أن طاقة التأين المرتفعة للذرة تعني أن الإلكترون في الذرة عالي الثبات.
وهذا كما يحدث فى حالة الهالوجينات حيث أنها جميعها تكون أيونات سالبة عالية الثبات
(ب) عندما يكون الميل الإلكتروني كبير وموجب فأنه يدل على أن الأيون السالب منخفض الثبات.
وهذا كما يحدث عند إضافة إلكترون لغاز خامل مثل النيون لأن ذرة النيون بها عشرة إلكترونات (2,8) وهو ما يمثل ترتيباً إلكترونياً ثابتاً إلى حد كبير وعند إضافة إلكترون إليها تعطي أيوناً سالباً (-Ne) به إحدى عشر إلكتروناً وهو ترتيب غير ثابت ويستدعي ذلك امتصاص قدر من الطاقة لإحداث ذلك.
- الميل الإلكتروني الثاني هو أننا نضيف إلكترونًا سالب الشحنة إلى أنيون. إذن فالأيون السالب سيطرد الإلكترون بطبيعة الحال، وهذا يزيد من الطاقة المطلوبة لضمهما معًا. بسبب هذا يكون الميل الإلكتروني الثاني سالبًا دائمًا، ومن ثم ماصًّا للحرارة.