قوانين المولارية Molarity
المولارية هي عدد المولات من المذاب فى لتر من المحلول ويرمز لها بالرمز (M)
(1) العلاقة بين المولارية وعدد المولات
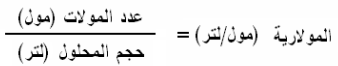
(2) المولارية ووزن المادة بالجرام
- يحسب عدد المولات من القانون التالي:
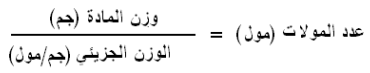
وبالتعويض فى القانون الأول عن عدد المولات نحصل على:

ومنها نحصل على القانون الثاني للمولارية والأهم على الأطلاق فى حساب المولارية:

(3) العلاقة بين المولارية والعيارية
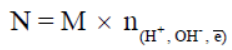
حيث n : تعبر عن عدد المولات من وحدات أيونات الهيدروجين (H+) أو الهيدروكسيد (OH-) أو عدد الإلكترونات المشاركة فى تفاعلات الأكسدة والاختزال .
(4) العلاقة بين المولارية ووحدة ppm ووحدة ppb
العلاقة بين المولارية ووحدة ppm ووحدة ppb تعطي من العلاقة:
ppm = molarity (M) x molecular weight (g/mol) x 103
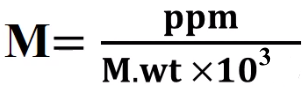
ppb = molarity (M) x molecular weight (g/mol) x 106
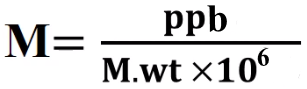
(5) العلاقة بين المولارية والنسبة المئوية الوزنية والكثافة

وهذا هو القانون الشائع لأيجاد تركيز الأحماض والقواعد من نسبته المئوية الوزنية والكثافة.