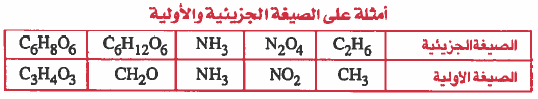
الصيغ الكيميائية Chemical Formula
- تنقسم الصيغ الكيميائية إلى:
(1) الصيغة الأولية (التجريبية) (الوضعية) (البسيطة) Empirical Formula
هي الصيغة التي تبين أبسط نسبة عددية صحيحة بين أعداد الذرات في الجزيء الواحد.
(۲) الصيغة الجزيئية Molecular Formula
هي الصيغة التي تبين العدد الفعلي للذرات في الجزيء الواحد .
(۳) الصيغة البنائية (التركيبية) Structural Formula : هي الصيغة التي تبين كيفية ترابط الذرات مع بعضها البعض في الجزيء .
مثال: اذكر الصيغة الأولية والجزيئية والبنائية لحمض الخل

الصيغة الجزيئية Molecule formula
لكي نتعرف على حسابات الصيغة يجب علينا في البداية أن نتعلم كيفية قراءة الصيغة ، لذلك سوف ناخذ الأمثلة التوضيحية التالية كمدخل للفهم :
مثال توضيحي (1): على ماذا يحتوي الجزيء الواحد من كل من:
H2 , H2O , C6H12O6
الحل :
(۱) الجزيء الواحد من H2 يحتوي على 2 ذرة من H
(۲) الجزيء الواحد من H2O يحتوي على : 2 ذرة من H و 1 ذرة O أو يحتوي على : 1 جزيء من H2 و 1 ذرة O
(۳) الجزيء الواحد من C6H12O6 يحتوي على: 6 ذرة كربون و 12 ذرة من H و 6 ذرة O أو 6 ذرة كربون و 6 جزيئات H2 و 6 ذرة O
مثال توضيحي (2): على ماذا يحتوي المول الواحد من الجزيئات التالية :
H2 , H2O , C6H12O6
الحل :
(1) 1 مول من جزيئات الهيدروجين H2 يحتوي على: 2 مول من ذرات الهيدروجين H
(2) 1 مول من جزيئات الماء H2O يحتوي على:
2 مول من ذرات H و 1 مول من ذرات O او 1 مول من جزيئات H2 و 0.5 مول من جزيئات O2
(3) 1 مول من جزيئات C6H12O6 يحتوي على:
6 مول من ذرات C و 12 مول من ذرات H او 6 مول من ذرات C
أو 6 مول من ذرات C و 6 مول من جزيئات H2 و 3 مول من جزيئات O2
ملاحظات هامة
(1) هذه العناصر دائماُ تتواجد على هيئة جزيئات :

(2) الرمز (M) يعني وزن مول من الذرات أو الجزيئات = الكتلة المولية = الوان الجريني
(3) تذكر الرموز التالية :
- الوزن بالجرام (m) ، الوزن بالجرام = m ، عدد المولات = n ، عدد أفوجادرو = NA ، ذرة = atom ، جزئ = Molecule
- عندما نكتب MH2O فإننا نعني الوزن الجزيئي للماء أو وزن مول من جزيئات الماء .
- عندما نكتب MH فإننا نعني الوزن الذري للهيدروجين أو وزن مول من ذرات الهيدروجين .
- عندما نكتب nAl2O3 فإننا نعني عدد مولات أكسيد الألمنيوم .
- عندما نكتب msi فإننا نعني وزن السيليكون .
- عندما نكتب Ns فإننا نعني عدد ذرات الكبريت .
- عندما نكتب NNO2 فإننا نعني عدد جزيئات ثاني أكسيد النيتروجين .
عندما نكتب +NNa فإننا نعني عدد أيونات الصوديوم .
ملاحظة : الرمز ( ~ ) يعني يكافىء او يحتوي على .
مسائل محلولة
مثال (1): إذا كان لدينا 3mol من كبريتات البـاريوم BaSO4 . فاحسب :
(۱) عـدد مـولات نرات الأكسجـين (O) الموجـودة في نفس الكمية.
(۲) عـدد مـولات جزيئات الأكسجين (O2) الموجـودة في نفس الكمية.
الحل:
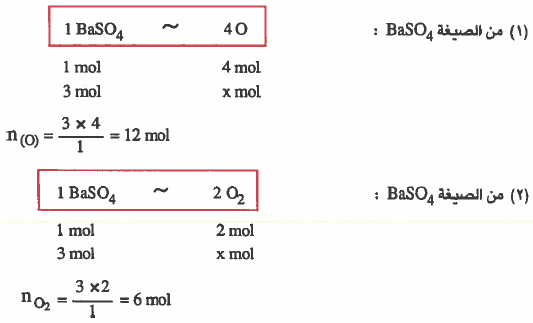
مثال (2): عينة من السكروز (C12H22O11) كتلتـهـا 0.5kg احـسـب عـدد مـولات الكربون الموجودة في هذه العينة.
الأوزان الذرية : 12 = O = 16 , H =1 , C
الحل :

مثال (3): احـسب وزن ذرات النيـتـروجين (N) الموجـودة فـي عـيـنـة مـن نـتـرات الكالسيوم 2(Ca(NO3 كتلتها 32.8g .
الأوزان الذرية : 40 = N = 14 , O = 16 , Ca
الحل:
الطريقة الأولي:

تذكر أن:
الرمز( M ) يعني الكتلة المولية (وزن مول من الذرات أو الجزيئات) ، ويساوي عددياً :
- الوزن الجزيئي (molecule weight) إذا كانت المادة على هيئة جزيئات.
- الوزن الذري (atomic weight) إذا كانت المادة على هيئة ذرات.
الطريقة الثانية (طريقة مختصرة):
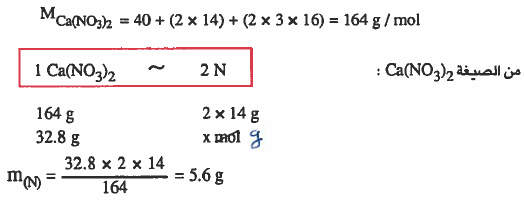
مثال (4): احسب عدد نرات الكربون في عينة من كربونات الحديد Fe2(CO)3 كتلتها 36.5g
الأوزان الذرية: 56 = C = 12 , O = 16 , Fe
الحل:
