مركب وزنه 100g يحتوي عناصر S ,O, Sr كتلة Sr = 47.7 g و S = 17.46 g والوزن الجزيئي للمركب 184 g/m
أوجد الصيغة الجزيئية للمركب؟
الحل:
أولاً: حساب الصيغة الأولية للمركب
(1) وزن المركب 100 جم فيكون:
Sr ⇒ 47.7 g
S ⇒ 17.46 g
(17.46 - O ⇒ 34.84 g (100 - 47.7
(2) حساب عدد المولات لكل عنصر
عدد المولات لكل عنصر = وزن العنصر فى المركب / الوزن الذري للعنصر
الوزن الذري لعنصرالسترونشيوم = 87.62g/mol
الوزن الذري لعنصر الكبريت = 32.06g/mol
الوزن الذري لعنصرالأكسجين = 16g/mol
فيكون عدد المولات لكل عنصر كالتالي:
Sr ⇒ 47.7 g / 87.62 gmol = 0.544
S ⇒ 17.46 g / 32.06 g/mol = 0.544
O ⇒ 34.84 g / 16 g/mol = 2.178
(3) نقسم على أقل نسبة من نسب العناصر السابقة
أقل نسبة للعناصر هي 0.544 لذلك نقسم جميع النسب السابقة على 0.544 فيكون:
Sr ⇒ 0.544 / 0.544 = 1
S ⇒ 0.544 / 0.544 = 1
O ⇒ 2.178 / 0.544 = 4
وعلى ذلك تكون الصيغة الأولية (الصيغة الوضعية) للمركب هي SrSO4
ثانياً: حساب الصيغة الجزيئية
الكتلة المولية للصيغة الوضعية SrSO4
= (4 × 16) + 32.06 + 87.62 = 183.68g/mol تقريباُ
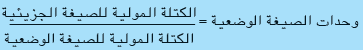
= 184/183.68 = 1
الصيغة الجزيئية = الصيغة الوضعية × وحدات الصيغة الوضعية
الصيغة الجزيئية = 1 × SrSO4= SrSO4
الصيغة الجزيئية هي SrSO4