الطيف الخطي للهيدروجين Line Spectrum of hydrogen
- كـمـا ذكـرنـا أن لكل عنصـر طيف خطي خـاص، ويمكن الحـصـول على الـطيـف الخطي للهيدروجين ، وذلك بوضع غاز الهيدروجين في أنبوب تفريغ كهربي ثم تسليط فرق جهد عالي عند ذلك تشع الذرات ضـوء ، وعند إمـرار شـعـاع ضـيـق من هذا الضـوء عـبـر مـنشـور يـتـحلل االضوء وتظهر اربع خطوط طيفية ملونة منفصلة (متباعدة) وهي :
(أحمر ، أزرق مائل للإخضرار ، ازرق ، بنفسجي)
- وحيث أن الضوء الصادر من العنصر عند التسخين يختلف باختلاف العنصر ، لذلك فإن لكل عنصـر طيف خطي مميز ويمكن تشبـيـهـه ببـصـمـة الأصـبع، فـمـثـلأ الطيف الذري الخـاص بالهيدروجين يختلف عن الطيف الخاص بالصوديوم وهكذا . وهذا يعني أنه:
(1) يمكن التعرف على العنصر من شكل الطيف الصادر عنه.
(2) لا يوجد عنصران لهما نفس الطيف الخطي.
- يعتبر الطيف الخطي للهيدروجين بسيطاً وذلك لأن ذرة الهيدروجين تحتوي على إلكترون واحد وبروتون واحد ولا يوجد بها نيترون
أنواع المتسلسلات الطيفية Spectrum Series فى ذرة الهيدروجين
استفاد العلماء من معادلة رايدبيرج والتى تنص على:

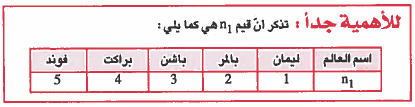
وتوصلوا إلى سلاسل طيفية للهيدروجين بالاعتماد على قيم n1 ، وقد سميت كل مجموعة بإسم مكتشفها وهي كما يلي:
(1) سلسلة ليمان (Lyman)
هو الضوء الناتج عن انتقال الإلكترون من إي مستوى رئيسي (1 < n2) إلى المستوى الرئيسي الأول (1 = n1) . وتقع سلسلة ليمان ضمن الطيف فوق البنفسجي (UV) .
(2) سلسلة بالمر (Balmer)
هو الضوء الناتج عن انتقال الإلكترون من أي مستوى رئيسي (2 < n2) إلى المستوى الرئيسي الثاني (2 = n1) . وتقع سلسلة بالمر ضمن الطيف المرئي (VL) .
(3) سلسلة باشن (Paschen)
هو الضوء الناتج عن انتقال الإلكترون من أي مستوى رئيسي (3 < n2) إلى المستوى الرئيسي الثالث (3 = n1) . وتقع سلسلة باشن ضمن الطيف تحت الأحمر (IR) .
(4) سلسلة براكت (Bracket)
هو الضوء الناتج عن انتقال الإلكترون من أي مستوى رئيسي (4 < n2) إلى المستوى الرئيسي الرابع (4 = n1) . وتقع سلسلة براكت ضمن الطيف تحت الأحمر (IR) .
(5) سلسلة فوند (Pfund)
هو الضوء الناتج عن انتقال الإلكترون من أي مستوى رئيسي (5 < n2) إلى المستوى الرئيسي الخامس (5 = n1) . وتقع سلسلة فوند ضمن الطيف تحت الأحمر (IR).
ملخص ماسبق