كيف تتكون الرابطة التساهمية حسب نظرية رابطة التكافؤ (VBT)
يمكن توضيح كيفية تكون الرابطة التساهمية حسب الخطوات الآتية:
(1) تتقارب الذرتان من بعضهما
(2) تقدم كل ذرة مداراً ذرياً نصف ممتليء أي يحتوي على إلكترون منفرد.
(3) عندما تتقارب الذرتان من بعضهما يحدث تداخل Overlap بين المدارين.
(4) نتيجة لهذا التداخل تتكون منطقة مشتركة في الفراغ الكائن بين نواتي الذرتين.
(5) يحتل الزوج الإلكتروني منطقة التداخل أي أن الكثافة الإلكترونية تتركز بين نواتي الذرتين وهذان الإلكترونان يدوران حول نفسهما في اتجاهين متعاكسين. وهذا الزوج الإلكتروني ينتمي إلى كلا الذرتين.
(6) نتيجة لوجود كثافة إلكترونية بين نواتي الذرتين ، فإن نواتي الذرتين الموجبتين تنجذبان نحو الكثافة الإلكترونية السالبة إلى أقصى حد ممكن ، وبذلك تتقارب الذرتان من بعضهما ، وبذلك تتكون الرابطة التساهمية.
(7) تزداد قوة الرابطة التساهمية بازدياد التداخل بين المدارات الذرية .
كيفية تكون الرابطة التساهمية في جزيء الماء H2O حسب نظرية رابطة التكافؤ (VBT)
- التركيب الإلكتروني لذرة الهيدروجين:
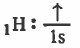
- ذرة الهيدروجين تحتوي على مدار نري ( 1s ) يحتوي على إلكترون منفرد .
- التركيب الإلكتروني لذرة الأكسجين:
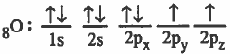
- ذرة الأكسجين تحتوي على مدارين (2p) كل منهما يحتوي على إلكترون مفرد.
(1) يحدث تداخل بين مـداري (p) نصف الممتلئين من ذرة الأكسجين مـع مـداري (1s) مـن ذرتي الهيدروجين ، وينتج عن ذلك تكون رابطتين تساهميتين .
(2) وكما هو معلوم أن مدارات (p) متعامدة على بعضها أي أن الزاوية بينها سوف تكون°90 .
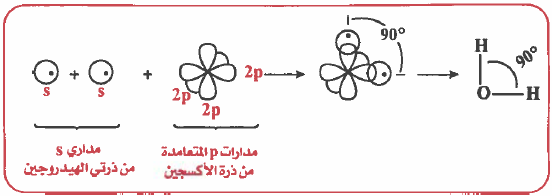
ولكن لوحظ عملياً ان الزاوية HOH تساوي °104.5 ، لهذا نستنتج أنه لا يمكن تفسير الزاوية HOH باستخدام مدارات نقية ، لذا سوف نلجأ إلى مفهوم التهجين لتفسير هذه HOH