كيفية تكون الرابطة التساهمية حسب نظرية رابطة التكافؤ (VBT)
يمكن توضيح كيفية تكون الرابطة التساهمية حسب الخطوات الآتية:
(1) تتقارب الذرتان من بعضهما
(2) تقدم كل ذرة مداراً ذرياً نصف ممتلىء أي يحتوي على إلكترون منفرد .
(3) عندما تتقارب الذرتان من بعضهما يحدث تداخل Overlap بين المدارين .
(4) نتيجة لهذا التداخل تتكون منطقة مشتركة في الفراغ الكائن بين نواتي الذرتين.
(5) يحتل الزوج الإلكتروني منطقة التداخل أي أن الكثافة الإلكترونية تتركز بين نواتي الذرتين وهذان الإلكترونان يدوران حول نفسهما في اتجاهين متعاكسين. وهذا الزوج الإلكتروني ينتمي إلى كلا الذرتين .
(6) نتيجة لوجود كثافة إلكترونية بين نواتي الذرتين ، فإن نواتي الذرتين الموجبتين تنجذبان نحو الكثافة الإلكترونية السالبة إلى أقصى حد ممكن ، وبذلك تتقارب الذرتان من بعضهما ، وبذلك تتكون الرابطة التساهمية .
(7) تزداد قوة الرابطة التساهمية بازدياد التداخل بين المدارات الذرية .
كيفية تكون الرابطة التساهمية في جزيء الميثان CH4 حسب نظرية رابطة التكافؤ (VBT)
- التركيب الإلكتروني لذرة الهيدروجين:
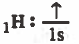
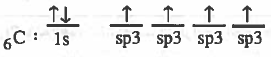
- التركيب الإلكتروني لذرة الكربون :
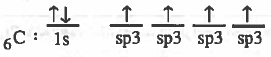
بتضح أن ذرة الهيدروجين تحـتـوي على مـدار نصف ممتليء ، والكربون يـحـتـوي على مدارين نصف ممتلئين . لذا سوف تتكون رابطتين تساهميتين فقط مع الهيدروجين ليتكون الجزيء (CH4) .
ولكن التجارب بينت أن هذا الجزيء غير مستقر ولا يوجد في الطبيعة كجزيء ثابت ، حيث وجد أن أصغر جزيء ثابت مكون من الكربون والهيدروجين هو الميثان (CH4) أي أن الكربون يجب أن يرتبط بأربع روابط .
ويمكن تفسير وجود اربع روابط من خلال استخدام ذرة كربون مثارة :
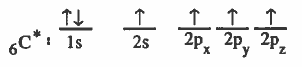
وبذلك يتوكن لدينا اربع روابط ، ثلاث منها متعامدة يستخدم بها مدارات ( p ) ورابطة أخرى لا اتجاه لها يستخدم فيها الكربون مدار ( 2s )
لكن وجد عمليا ان جميع الروابط متكافئة والزوايا بيتها °109.5 ، ويمكن تفسير ذلك من خلال مفهوم التهجين ، حيث يتم دمج المدارات الأربعة لينتج لدينا أربعة مدارات متساوية في الشكل والطاقة