الضغط الأسموزي Osmotic Pressure
ماذا تعني بالخاصية الأسموزية ؟
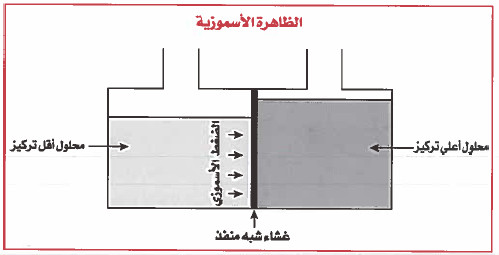
- الخاصية الأسموزية هي مرور جزيئات السائل من المحلول المخفف إلى المحلول الأكثر تركيز عبر غشاء شبه منفذ.
توضيح
- عند وضع غشاء شبه منفذ بين محلولين مختلفي التركيز ، فإن الغشاء يسمح بمرور الماء (المذيب) (السائل) في كلا الاتجاهين ، لكن في البـدايـة سـوف يمر الماء بشكل أكـبـر نـحـو المحلول ذي التركيز الأعلى ، حتى نصل إلى حالة الاتزان وعندها يكون مرور الماء في الاتجاهين متساو.
- والنتيجة المتوقعة ان يرتفع مستوى السائل في المحلول ذي التركيز الأعلى ، والفرق في الارتفاع بين المنسوبين يوازي الفرق في الضغط.
- وعند الاتزان فإن الفرق في الضغط يسمى بالضغط الاسموزي.
الغشاء شبه للنفذ
- الغشاء شبه للنفذ هو غشاء يسمح بمرور جزيئات المذيب ولا يسمح بمرور المذاب.
- ومن الأمثلة عليه مثانة بعض الحيوانات أو السيلوفان أو الجلد الرقيق مثل الجلاتين.
لماذا يتجه الماء من الجهة الأقل تركيز إلى الأعلى تركيز ؟
هذه الظاهرة سببها أن حركة الجزيئات في المحلول الأقل تركيز أسرع منها في المحلول المركز وكما هو معلوم أن الضغط البخاري في المحلول المخفف أعلى منه في المحلول المركز ولذلك فإن جزيئات الماء تسير من المحلول المخفف باتجاه المحلول المركز.
الضغط الاسـمـوزي العكسي
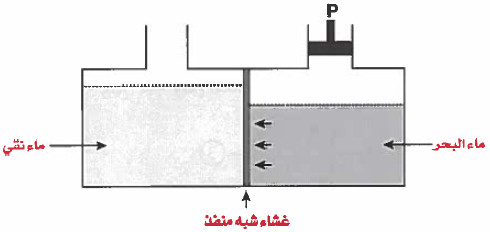
- ويمكن أن نجعل اتجاه الماء الموجود في المحلول الأعلى تركيز ينفذ عبر الغشاء إلى المحلول الأقل تركيز بزيادة الضغط على الـجـهـة الأعلى تركيز وهو ما يسمى بالضغط الاسـمـوزي العكسي .
- ويمكن الاسـتـفـادة من هذه الظاهرة في تحلية المياه ، فـمـثـلاً يوضع يوضع الماء المقطر في إناء ، وتوضع مياه البحر في إناء آخر يفصل بينهما غشاء رقيق.
- ومن الطبيعي أن يسري الماء المقطر نحو مياه البحر ، ولكن عند وضع ضغط خارجي في الإناء الذي يحـتـوي على ماء البحر بحيث يكون الضغط أكبر من الضغط الاسموزي للماء النقي فإنه يحدث ضغط اسموزي عكسي ، عندئذ تنتقل مياه البحر نحو المياه المقطرة وتترك وراءها الأملاح والشوائب ، وبذلك يمكن تحلية كميات كبيرة من مياه البحر بهذه الطريقة.
القوانين المستخدمة لحساب الضغط الاسموزي (π)
- وقد وجد عملياً أن الضغط الاسموزي (π) يتناسب طردياً مع التركيز (C) ويتناسب طرديا مع درجة الحرارة المطلقة (Τ)
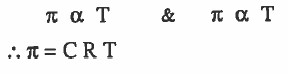
- بالنسبة للمحاليل المخففة يمكن إيجاد الضغط الاسموزي باستخدام مـعـادلـة فانت هوف للمحاليل المخففة.
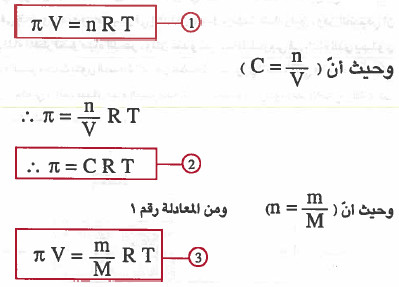
حيث أن:
π = الضغط الاسموزي بوحدة atm
V = حجم المحلول باللتر
R = ثابت الغازات (0.0821)
n = عدد المولات المذاب
m = الوزن بالجرام للمذاب
T = درجة الحرارة المطلقة (كالفن)
C = التركيز بالمولارية
M = الوزن الجزيئي للمذاب ( الكتلة المولية للمذاب )
مسائلة محلولة على الضغط الأسموزي
مثال (1): احسب الضغط الأسموزي π لمحلول 0.155M من الجلوكوز عند درجة °25C
الحل:
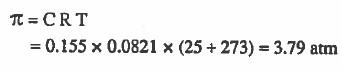
يرجى الضغط على الرابط في حال أردت مسائل محلولة أكثر عن الضغط الأسموزي
مسائلة محلولة على الضغط الأسموزي