القانون الثاني في الثرموديناميك
The Second Law of Thermodynamics
- نص القانون الثاني للثرموديناميك:
(كل تغير تلقائي لا بد وأن ترافقه زيادة في الانتروبي وتبقى ثابتة في حالة الاتزان)
- بمعنى أن التغير الكلي في الانتروبي ΔS هو الذي يحدد كون العملية تلقائية أم لا:

حيث أن:
ΔSS : التغير في الانتروبي للنظام .
ΔSr : التغير في الانتروبي للمحيط.
ويمكن توضيح ذلك كما يلي:
(1) تكون العملية تلقائية إذا كانت قيمة ΔSt الكلية أكبر من الصفر (موجبة).
(2) تكون العملية غير تلقائية إذا كانت قيمة ΔSt الكلية أقل من الصفر (سالبة)
توضيح تكون العملية تلقائية إذا كانت قيمة ΔS أكبر من الصفر (موجبة) بغض النظر عن كون التغير في انتروبي النظام موجب أو سالب ، كما في المثال التالي:
مثال لو حصل تغير فيزيائي ما ، ووجد أن :
قيمة التغير في الانتروبي للنظام : ΔSs = -10 J / K
قيمة التغير في الانتروبي للمحيط : ΔSr = +11 J/K
ΔSt = ΔSS + ΔSr
(11+) + (10-) =
1J/K + =
- التغير الكلي في الانتروبي ΔSt بالموجب إذن التغير في هذه الحالة تلقائي ، رغم أن التغير في الانتروبي للنظام ΔSs بالسالب (أي أن الانتروبي للنظام ينقص).
- لذلك يجب ان نأخذ دائماً بعين الاعتبار التغير في الانتروبي للمحيط عند حدوث أي تغير ولا نركز فقط على انتروبي النظام
ملاحظة : عندما تكون العملية في حالة اتزان فإن ΔS = zero أي أن : ΔSs = ΔSr
- مما سبق يتبين لنا أن قيمة التغير في الانتروبي للنظام فقط قد لا تساعدنا بشكل كامل في التعرف على تلقائية التفاعل ، وحيث انه يصعب في كثير من العمليات الحصول على التغير في الانتروبي للمحيط ، لذلك سوف نلجأ لخاصية ثرموديناميكية وهي التـغيـر في الطاقة الحرة (التغير في طاقة جبس الحرة) ΔG . والتي يمكن إيجادها بالقانون التالي:
ΔG = ΔH - TΔS
التغير في الانتروبي في التحولات الفيزيائية
- عند حدوث تغير فيزيائي مثل الانصهار أو الغليان او التسامي أو التبخر فإن التغير في هذه الحالة يكون في حالة اتزان.
- فمثلاً عند درجة غليان الماء يكون الماء السائل وبخار الماء في حالة اتزان : H2O (1) = H2O (g) والتغيرات الفيزيائية مثل الانصهار والغليان وغيره يرافقها تغير في الانتروبي ويمكن التوصل لقيمة ΔS كما يلي:

وعندما يكون الضغط ثابتا فإن : ΔH = qp
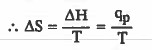
ΔS = التغير في الانتروبي ووحدته (J / K mol)
ΔH = التغير في الإنثالبي ووحدته (J)
q = كمية الحرارة التي يمتصها النظام في حالة التغير العكسي ووحدتها بالجول (J)
T = درجة الحرارة المطلقة (بالكلفن)
ملاحظات هامة:
- يفضل استخدام الجول (J) عن الكيلو جول (kJ) للتغير في الانتروبي وذلك لأن قيم التغير في الانتروبي صغيرة.
- هذا القانون ينطبق فقط عند وجود حالة اتزان مستمرة ، فمثلاً عند تحول المادة من حالة إلى حالة ، أو يكون تفاعل في حالة اتزان.
سؤال: لماذا يجب علينا استخدام (q) عند حساب ΔS لنظام ما .
جواب: لأن زيادة كمية الحرارة و المضافة للنظام يزيد كمية الفوضى (العشوائية)