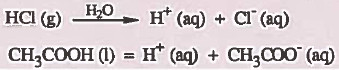المحاليل والتوصيل الكهربي Solutions and Electric Conductance
تنقسم المحاليل من حيث توصيلها للتيار الكهربي إلى:
(1) الإكتروليتات (المحاليل الموصلة للتيار الكهربي)
(2) اللاإلكتروليتات (المحاليل غير الموصلة للتيار الكهربي)
أولاً/ المحاليل الموصلة للتيار الكهربي ( الإلكتروليتات )
- الالكتروليت هي المادة التي تذوب في الماء وتعطي محلولاً موصلاً للتيار الكهربي.
- وتنقسم الإلكتروليتات إلى:
(1) إلكتروليتات قوية
(2) إلكتروليتات ضعيفة
الإلكتروليتات القوية Strong Electrolytes
- هي مركبات تتفكك لو تتأين كلياً في الماء إلى أيونات موجبة وسالبة.
- ومن الأمثلة على الإلكتروليتات القوية:
(1) المركبات الأيونية
- والمركبات الأيونية مثل كلوريد الصوديوم عند إذابتها في الماء تتفكك كلياً في الماء إلى أيونات وتصبح محاليلها موصلة للتيار الكهربي.
- مثال:
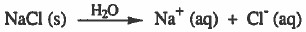
- التفكك: هو فصل الروابط الموجودة أصلاً بين الأيونات في المركب الأيوني وجعلها حرة الحركة بفعل الماء أو الانصهار.
(2) المركبات القطبية
- والمركبات القطبية مثل كلوريد الهيدروجين عند إذابتها في الماء تتأين كلياً في الماء إلى أيونات وتصبح محاليلها موصلة للتيار الكهربي.
- مثال:
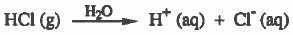
- التأين: هو تحويل الجزيئات غير الأيونية إلى أيونات وجعلها حرة الحركة في الماء
الإلكتروليتات الضعيفة Weak Electrolytes
- الإلكتروليتات الضعيفة: هي مركبات تنوب في الماء وتتأين جزئيا في الماء .
- أمثلة:
CH3COOH (1) = H+ (aq) + CH3COO- (aq)
H2O (1) = OH- (aq) + H+ (aq)
ثانياً/ المحاليل غير الموصلة للتيار الكهربي (اللاإلكتروليتات)
- تعریف اللاإلكتروليتات: هي مركبات تعطي محلولاً غير موصل للتيار الكهربي ، لأنها لا تتفكك او تتأين في الماء .
- مثال: الجلوكوز C6H12O6
أسئلة هامة على أنواع المحاليل من حيث التوصيل الكهربي؟
علل: محلول حامض الخليك ضعيف التوصيل للكهرباء؟
السبب: لأن حامض الخليك الكتروليت ضعيف (يتفكك جزئياً في الماء)
علل: مع ذكر المعادلات اللازمة محلول حمض الكلور يوصل التيار الكهربي بدرجة أكبر من محلول حامض الخليك ؟
السبب: لأن محلول حامض الكلور الكتروليت قوي (يتأين كلياً) أما حامض الخليك فهو الكتروليت ضعيف (يتفكك جزئيا في الماء)