مفهوم أرهينيوس (النظرية الأيونية) Arrhenius Concept
تعريف الحمض حسب مفهوم أرهينيوس
هي المادة التي تزيد من تركيز أيونات الهيدرونيوم (+H3O) في المحاليل المائية.
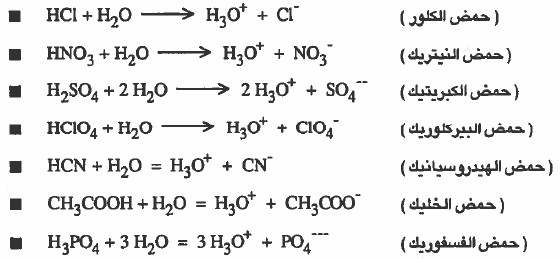
تعريف القاعدة حسب مفهوم أرهينيوس
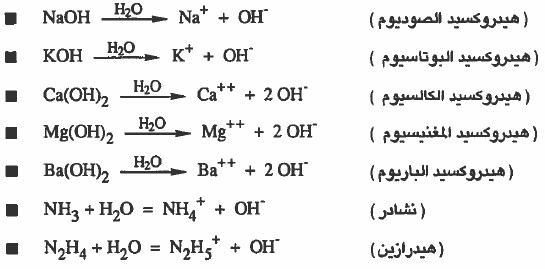
المادة التي تزيد من تركيز ايونات الهيدروکسید (OH) في المحاليل المائية.
- تعتمد قوة الحمض او القاعدة على مدى تفككه في الماء إلى أيونات.
توضيح لنظرية أرهينيوس
(1) المادة التي تتفكك او تتأين في الماء إلى أيونات الهيدرونيوم +H3O تعتبر حمض.
(2) المادة التي تتفكك أو تتأين في الماء إلى أيونات الهيدروكسيد OH- تعتبر قاعدة.
(3) المادة التي تتفكك أو تتأين كلياً إلى أيونات الهيدرونيوم تعتبر حمضاً قوياً.
أمثلة: HClO4 ، HNO3 ، HCl
(4) المادة التي تتفكك او تتأين جزئياً إلى أيونات الهيدرونيوم تعتبر حمضاً ضعيفاً.
أمثلة: HCN، CH3COOH.
(5) المادة التي تتفكك او تتأين كلياً إلى أيونات الهيدروكسيد تعتبر قاعدة قوية .
أمثلة: Ba(OH)2 , NaOH.
(6) المادة التي تتفكك أو تتأين جزئياً إلى أيونات الهيدروكسيد تعتبر قاعدة ضعيفة.
أمثلة : (NH3 (aq
أسئلة محلولة على نظرية أرهينيوس
(1) علل: حسب نظرية أرهينيوس يعتبر HNO3 حمضاً قوياً .
جواب: لأنه يتفكك كلياً إلى أيونات الهيدرونيوم
HNO3 (1) + H2O (l) → H3O+ (aq) + NO3(aq)
(2) علل: حسب نظرية أرهينيوس يعتبر سيانيد الهيدروجين حمضاً ضعيفاً.
جواب : لأنه يتفكك جزئياً إلى أيونات الهيدرونيوم:
HCN (g) + H2O (1) = H3O+ (aq) + CN- (aq)
(3) علل: حسب نظرية أرهينيوس يعتبر هيدروكسيد البوتاسيوم قاعدة قوية
جواب : لأنه يتفكك كلياً إلى أيونات الهيدروكسيد:
KOH (s) + H2O (1) → K+ (aq) + OH- (aq)
(5) علل: حسب نظرية أرهينيوس يعتبر سكر الجلوكوز لا حمض ولا قاعدة .
جواب : لأنه إذا وضع في الماء لا يتفكك إلى أيونات وبذلك فهو ليس بحمض أو قاعدة
(6) علل : حسب نظرية أرهينيوس يعتبر CH3COOH حمضاً ضعيفاً.
جواب : لانه يتفكك جزئياً في الماء لينتج أيونات الهيدرونيوم
CH3COOH (1) + H2O (1) = H3O+ (aq) + CH3COO- (aq)
(7) علل : حسب نظرية أرهينيوس يعتبر ملح الطعام لا حمض ولا قاعدة.
جـواب : لأنه إذا وضع في الماء يتفكك إلى أيونات ولكنه لا ينتج أيونات الـهـيـدرونـيـوم أو أيونات الهيدروكسيد وبذلك فهو ليس بحمض او قاعدة.
NaCl (s) + H2O → Na+ (aq) + Cl- (aq)
معلومات إضافية
مما يؤكد نظرية أرهينيوس ما يلي:
(1) HCl الجاف لا يؤثر على ورقة تباع الشمس إلا إذا وجد الماء الذي يلزم لتكوين أيونات الهيدرونيوم +H3O الحامضية التأثير.
(2) NH3 الجافة لا تؤثر على ورقة تباع الشمس إلا إذا وجد الماء الذي يلزم لتكوين ايونات الهيدروكسيد OH- القاعدية التأثير.