معادلة نيرنست Nernst Equation
- هي معادلة توضح العلاقة بين الجهد والتركيز The Relationship Between Potential and Concentration
- سبق أن أطلعت على الجدول الذي يحتوي على جهود الاختزال القياسية لبعض المواد ، والتي تم حسابها عند تركيز قدره (1molar) وضغط جوي واحد (1atm) و °25C
- وبالتالي فعند اختلاف التركيز مثلاً سوف تتغير قيمة جهد الاختزال للقطب .
- ويمكن من خلال معادلة نيرنست Nernst Equation حساب جهد الخلية عند أي تركيز.
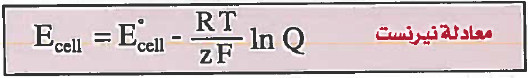
Ecell = جهد الخلية عند التراكيز الجديدة.
Eocell = جهد الخلية عند الظروف القياسية (المعيارية)
R = ثابت الغازات ويساوي (8.314volt coulomb / K. mol )
z = عدد الإلكترونات المنتقلة (المشاركة في نصف التفاعل) (المفقودة أو المكتسبة)
F = ثابت فاراداي وقيمته تساوي تقريباً ( coulomb 96500 )
ln = اللوغاريتم الطبيعي = 2.303 اللوغاريتم العشري.
Q = ثابت الاتزان اللحظي ويطلق عليه ثابت رائز ،
تعريف رائز التفاعل Q
- هو حاصل ضرب تراكيز النواتج على حاصل ضرب تراكيز المتفاعلات مرفوعاً كل مادة إلى أس يساوي معامل كل مادة في المعادلة الموزونة.
- أ و حاصل ضرب ضغوط النواتج على حاصل ضرب ضغوط المتفاعلات مرفوعاً كل مادة إلى اس يساوي معامل كل مادة في المعادلة الموزونة.
وبالتعويض عن قيمة (F , T , R) بالوحدات الدولية:
R = 8.314
T = 298
F = 96500
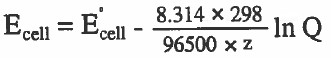
لتصبح المعادلة كما يلي:

ويمكن استخدام القانون التالي بدلاً من السابق أيضاً:
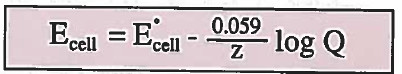
في حالة عدم وجود قيمة F , T فيمكن استخدام القوانين السابقة بدلاً من المعادلة أعلاه.
مسائل محلولة على معادلة نيرنيست
مثال (1): أحسب جهد الخلية الكهروكيميائية التي يمثلها التفاعل التالي:
Cd + Cu++ = Cd ++ + Cu
عندما يكون تركيز أيونات الكادميوم (0.001M) وأيونات النحاس (1M) وجهد الخلية القياسي (V0.767) افرض أن ثابت فاراداي 96500coulomb عند °25C
أوجد نسبة تركيز أيونات الكادميوم إلى أيونات النحاس عندما يصبح جهد الخلية يساوي صفر.
الحل:
من المعادلة يتبين أن عدد الإلكترونات المفقودة (z = 2)

مثال (2): التفاعل التالي يمثل خلية كهربية:
Cu(s) / Cu(aq) (0.1 M) || Ag(aq) (0.01 M) / Ag(s)
(۱) احسب جهد الخلية عند التراكيز المبينة.
(۲) ما نسبة تركيز ايونات الفضة إلى النحاس عندما يكون جهد الخلية يساوي 0.2V الجهد القياسي لقطب الفضة (0.8V) وقطب النحاس (0.34V)
الحل:
