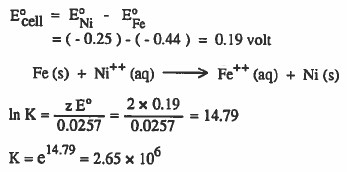العلاقة بين K و Eo
The Relationship Between K and E
- حسب القانون التالي : يمكن إيجاد العلاقة بين K و °E
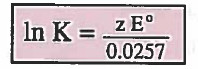
حيث أن:
z = عدد الإلكترنات المفقودة أو المكتسبة.
K = ثابت الاتزان.
°E = جهد الخلية أو جهد القطب القياسي.
ملاحظات هامة:
(1) إذا كانت 1 < K فإن 0 < Eo
(2) إذا كانت 1 >K فإن 0 > °E
(3) إذا كانت 0 = K فإن 0 = °E
مثال محلول:
احسب ثابت الاتزان للخلية:
E° (Fe2+ / Fe) = - 0.44
E° (Ni2+ / Ni)= - 0.25
الحل: