طرق تحضير الاثيرات
(1) انتزاع الماء من الكحولات
- تتم هذه الطريقة عند تفاعل الكحولات مع حمض الكبريتيك المركز عند درجات حرارة عالية نسبياً.
- هذه الطريقة جيدة وتستخدم في كل من المختبر وفي الصناعة لتحضير الايثرات المتماثلة غير المتفرعة.

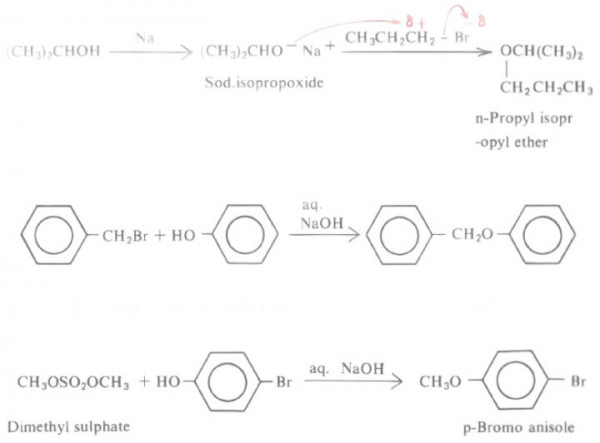
(2) تحضير ولیمسون Williamson's synthesis
- يتم وفقاً لهذه الطريقة تحضير الايثرات المتماثلة وغير المتماثلة.
- وذلك بتفاعل الملح الصوديومي للكحولات (أيون الكوكسيد alkoxide ion)، أو الملح الصوديومي للفينولات مع هاليد الألكيل عن طريق إستبدال نيكليوفيلي من الدرجة الثانية SN2
- يمكن الحصول على الملح الصوديومي للكحولات بتفاعل الكحول مع معدن الصوديوم. أما الملح الصوديومي للفينولات فيتم الحصول عليه بتفاعل الفينول بهيدروكسيد الصوديوم وذلك لأن الفينولات أكثر حمضية من الكحولات .
- هذا ويمكن استخدام كبريتات ثنائي ألكيل بدلاً من هاليدات الألكيل فهذه الاسترات لها فعالية شديدة.
- وتجدر الإشارة إلى أن كبريتات ثنائي الميثل تستخدم على نطاق واسع في الكيمياء العضوية كعامل مثيله (إدخال من مجموعة ميثل) إلى مركب آخر بدلاً من هاليدات الميثل الباهظة الثمن.
- كذلك فإن أيون الكوكسيد (الملح الصوديومي للكحولات) يمكن أن يكون مشتقاً من كحول أولي أو ثانوي أو ثالثي.
- بينما هاليد الألكيل لابد وأن يكون أولياً لأن كلا من هاليد الألكيل الثانوي أو الثالثي يخضع لحادثة الإنتزاع (E2) بدلاً الإستبدال من النيكليوفيلي (SN2).
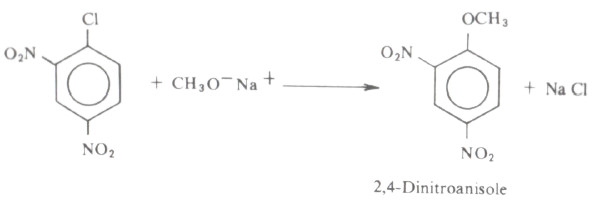
- ولا يمكن استخدام هاليدات الأريل في هذا التفاعل نظراً لخمولها الكيميائي تجاه الاستبدال النيكلوفيلي، إلا أنه يمكن استخدام هاليد أريل به مجموعات مثبطة على الحلقة الأروماتية الأمر الذي يزيد من فعالية ذرة الهالوجين في هذا المركب على سبيل المثال:
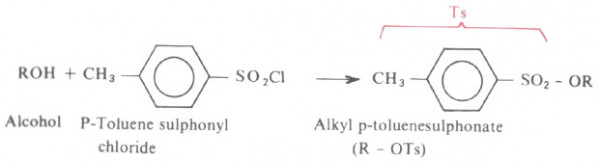
- ومما تجدر الإشارة إليه أنه يمكن استخدام مركبات تعرف بالتوسيليتات بدلاً من هاليدات الألكيل في تفاعل وليمسون لتنتج الايثرات.
- نحضر هذه المركبات بسهولة في المختبر من تفاعل بارا تولوئین سلفونيل كلوريد مع الكحول في وجود قاعدة ضعيفة وفقاً للمعادلة التالية : -
- وباستخدام مركبات التوسيليتات يمكن أن تحضر الايثرات المتماثلة أو غير المتماثلة كما يتضح من المعادلة التالية:
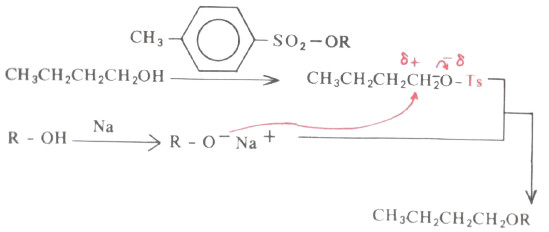
- واستخدام مركبات التوسيليتات في تحضير الايثرات بطريقة وليمسون بدلاً من هاليد الألكيل له الميزات التالية :
(1) يمكن تحضيرها بسهولة وبحصيلة جيدة.
(2) أنها أكثر فعالية من بروميدات الألكيل تجاه الإستبدال النيكلوفيلي وعليه تقل حادثة الانتزاع مع أيون الألكوكسيد مقارنة بهاليدات الألكيل.