طرق الكشف عن الألدهيدات والكيتونات
أولاً/ الاختبارات الكيميائية
(1) تتفاعل الألدهيدات والكيتونات مع مشتقات الأمونيا
تتفاعل الألدهيدات والكيتونات مع مشتقات الأمونيا مثل سيمي کربازید و 4،2 - ثنائي نيتروفينل هيدرازين وتتكون مشتقات صلبة يعتمد على درجات انصهار هذه المشتقات لتحديد نوعية الألدهيد أو الكيتون.
(2) كاشف تولينز Tollen’s Reagent
تتأكسد الألدهيدات بواسطة كاشف تولينز حيث يختزل أيون الفضة إلى الفضة المعدنية أي تنفصل على هيئة مرآة.
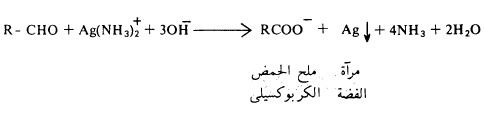
- ويتم تحضير محلول تولينز من إضافة محلول هيدروكسيد الصوديوم على محلول نترات الفضة ثم يضاف على المحلول الناتج محلول أمونيا مخفف حتى يذوب المترسب من أكسيد الفضة.
(3) محلول فهلنج Fehling Reagent
- من التفاعلات التي يمكن استخدامها للكشف عن المجموعة الألدهيدية هو تفاعلها مع محلول فهلنج حيث تتأكسد بواسطة هذا الكاشف ويختزل أيون النحاس الثنائي إلى أحادي متحولاً إلى راسب أكسيد النحاسوز ذي اللون الأحمر المائل إلى البني.
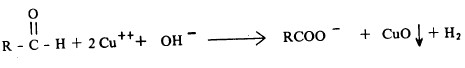
- ولا تتأكسد الكيتونات بواسطة هذا الكاشف سوى الكيتونات التي تحوي مجموعتي كربونيل متجاورة حيث تنفك الرابطة بين هاتين المجموعتين إثر الأكسدة.
- ويتم تحضير محلول فهلنج من إضافة كبريتات النحاس المائية على طرطرات البوتاسيوم والصوديوم (ملح روشل) ثم يضاف على المحلول الناتج محلول هيدروكسيد الصوديوم.
(4) تفاعل الهالوفورم Haloform Reaction
- ويمكن استخدامه للتعرف على مركبات الكيتونات التي تحوي مجموعة CH3CO. أما بالنسبة للألدهيدات فلا تخضع لهذا الكشف عدا الأسيتألدهيد، فهو الألدهيد الوحيد الذي يحوي مجموعة CH3CO.
ثانياً/ التحليل الطيفي للألدهيدات والكيتونات
(1) طيف IR
- يمكن إدراك وجود مجموعة الكربونيل بسهولة وذلك باستخدام أطياف IR إذ يتراوح امتصاصها في 1690 - 1730 سم-1 في معظم الألدهيدات والكيتونات غير الحلقية وذوات الحلقات السداسية، وهذا الامتصاص نتيجة اهتزازات شد الرابطة بين الكربون والأكسجين C=O.
- وباستخدام هذه الوسيلة الطيفية يمكن التمييز بين المركب الألدهيدي والمركب الكيتوني حيث تتميز الألدهيدات بوجود حزمة طيفية فى المنطقة 1720 - 1820 سم-1 نائشة عن شد رابطة C - H في المجموعة الألدهيدية.
- تمتص معظم الكيتونات ذوات السلاسل المفتوحة وكذلك ذوات الحلقات السداسية فأعلى في المنطقة 1700 سم-1 في حين تمتص الكيتونات ذات الحلقات الصغيرة عند عدد موجي أعلى.
وعليه يستفيد دارس الكيمياء العضوية من تحديد حجم الحلقة في الكيتونات الحلقية الخماسية فأصغر باستخدام هذه الوسيلة الطيفية.
سيكلوبروبانون 1815 سم-1
سيكلو بيوتانون 1775 سم-1
سيكلو بنتانون 1745 سم-1
- وعندما يتوفر النظام المتناوب كما في ألفا - بيتا - كيتونات وألدهيدات غير مشبعة فإن الامتصاص يحدث عند عدد موجي أقل:

- وتتميز حزم امتصاص مجموعة C=O في أطياف IR بأنها حادة وكثيفة في جميع الكيتونات والألدهيدات.
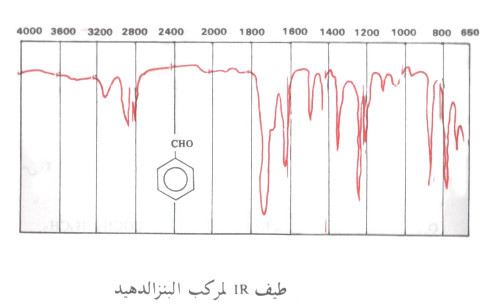
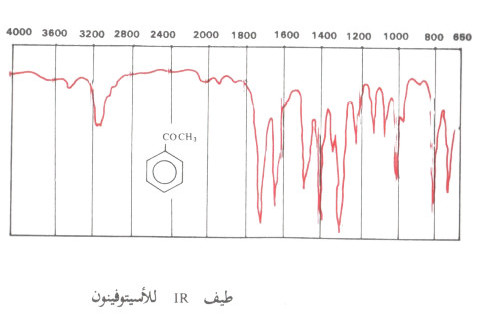
(2) أطياف NMR
- تعتبر أطياف الطنين النووي المغناطيسي (NMR) من أهم الوسائل الطيفية للتعرف على الألدهيدات.
- حيث أن ذرة هيدروجين المجموعة الألدهيدية تمتص عند مجال منخفض في العادة عند حوالي 9.5 - 10.0 دلتا.
- ويتحدد هذا المجال لامتصاص ذرة الهيدروجين بسبب طبيعة مجموعة الكربونيل الساحبة للالكترونات التي تسبب إزاحة لهذه الذرة إلى مجال منخفض.
- وتزيح أيضاً مجموعة الكربونيل ذرات هيدروجين ألفا إلى مجال منخفض.
(3) طيف الكتلة
- في العادة يمكن ملاحظة الأيون الجزيئي في أطياف الكتلة لكل من الألدهيدات والكيتونات بيد أنه أكثر كثافة في حالة الكيتونات.
- ويحدث الانشطار في أفراد كلا الطائفتين بين ذرة كربون مجموعة الكربونيل وبين ذرة الكربون المجاورة ويتكون أيون أسيليوم acylium ion.
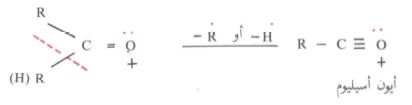
- ويكون هذا الأيون أكثر ثباتاً فى الألدهيدات والكيتونات الأروماتية حيث تعطي هذه المركبات أيوناً جزئياً بوفرة عالية.