تطور النماذج الذرية
- الذرّات هي مجموعات من البروتونات والنيوترونات التي تكوّن النواة ، وتحيط بها الإلكترونات.
- على الرغم من أنّ هذا النموذج قد تمّ العمل به جيدًا ، إلّا أنّ فاعليته لم تستمر لأنه لا يفسّر سوى القليل من الخواصّ البسيطة للذرّات.
- فلا يفسّر ، على سبيل المثال ، سبب ظهور ألوان مميزة عند تسخين الفلزات أو المركّبات على اللهب ، ولا أنّ الخواص الكيميائية للذرّات والأيونات والجزيئات ترتبط بترتيب الإلكترونات داخل كل منها ، فكان من الضروري تطوير نماذج ذرّية أخرى.
(1) نموذج دالتون Dalton’s Model
- وضع دالتون أول نظرية عن تركيب الذرّة بناء على الكثير من التجارب والأبحاث التي أجراها ، وافترض ما يلي:
- يتألّف العنصر من جسيمات صغيرة جدًّا ، لا تتجزّأ ، تسمّى الذرّات.
- تتشابه ذرّات العنصر الواحد في الخواص وتتساوى في الكتلة.
- تختلف ذرّات العناصر المختلفة في الخواص والكتل.
- تتفاعل ذرّات العناصر مع بعضها بنسب ثابتة لتكوين المركّبات.
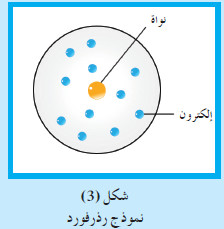
(2) نموذج طومسون Thomson’s Model
- أجرى طومسون تجارب على التفريغ الكهربائي خلال الغازات داخل أنبوب زجاجي.
- وكان ما افترضه أنّ الذرّة عبارة عن كرة مصمتة تتوزّع على سطحها جسيمات سالبة الشحنة.
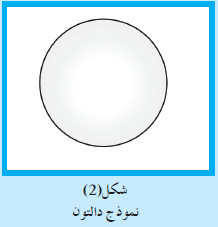
(3) نموذج رذرفورد Rutherford’s Model
- قام جيجر ومارسيديان ، تحت إشراف رذرفورد ، بإرسال سيل من جسيمات ألفا الموجبة الشحنة على شريحة رقيقة من الذهب.
- وبعد أن شاهد رذرفورد التجربة ، افترض ما يلي:
- تشبه الذرّة المجموعة الشمسية (تدور الإلكترونات سالبة الشحنة حول نواة مركزية) .
- معظم الذرّة فراغ ، وحجم النواة صغير جدًّا بالنسبة إلى حجم الذرّة.
- تتركّز كتلة الذرّة في النواة (لأنّ كتلة الإلكترونات صغيرة جدًّا مقارنة بكتلة مكوّنات النواة من البروتونات والنيوترونات) .
- يوجد في الذرّة نوعان من الشحنات (شحنة موجبة في النواة تدعى بروتونات وشحنة سالبة حول النواة تدعى إلكترونات) .
- الذرّة متعادلة كهربائيًّا لأنّ عدد الشحنات الموجبة يساوي عدد الشحنات السالبة .
- تدور الإلكترونات حول النواة في مدارات خاصة.
- حين يدور الإلكترون حول النواة ، يخضع لقوتين الأولى قوة جذبها للإلكترونات والأخرى القوة المركزية الناشئة عن دوران الإلكترونات حول النواة.
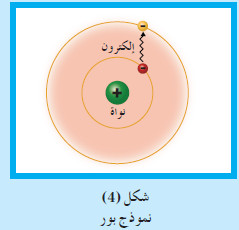
(4) نموذج بور Bohr’s Model
- من خلال طيف الانبعاث الخطّي لذرّات الهيدروجين ، تمكّن بور من وضع نموذجه الذرّي ، وافترض ما يلي:
(أ) يدور الإلكترون حول النواة في مدار ثابت .
(ب) للذرّة عدد من المدارات، لكل منها نصف قطر ثابت وطاقة محددة .
- يمثل كل مدار مستوى معيناً من الطاقة، يشار إليه بالحرف (n) الذي يتخذ قيمًا عددية صحيحة بدءًا من n = 1 ، وهو الأقرب إلى النواة ، وصولا إلى ∞ = n الذي يكون فيه الإلكترون بعيدًا جدًا عن النواة.
(جـ) لا يشع الإلكترون الطاقة ولا يمتصها ما دام يدور في المسار نفسه حول النواة.
(د) يمكن للإلكترون أن ينتقل من مستوى طاقة إلى مستوى آخر ، إذا غيّر طاقته بما يتناسب مع طاقة المستوى الجديد.
- فعند إثارة الذرّة ، يمتصّ الإلكترون طاقة لينتقل إلى مستوى أعلى ، في حين يشع طاقة إذا انتقل إلى مستوى طاقة أدنى ، فيتكون عندئذ طيف الإشعاع الخطي.