(1) لم يستطع تفسير الطيف الخطي لأي ذرة أخرى غير ذرة الهيدروجين ، والتى تمثل أبسط نظام إلكتروني ، حيث لا تحتوي الذرة إلا على إلكترون واحد.
(2) اعتبر أن الإلكترون مجرد جسيم مادى سالب الشحنة ، ولم يأخذ في الاعتبار أن له خواص موجية.
(3) افترض إمكانية تحديد موقع وسرعة الإلكترون معاً بدقة ، والواقع أن هذا مستحيل عملياً.
(4) اعتبر أن الإلكترون جسيم يتحرك في مسار دائري مستوي ، وهو ما يعني أن ذرة الهيدروجين مسطحة، وقد ثيت بعد ذلك أن الذرة لها الاتجاهات الفراغية الثلاثة.
النظرية الذرية الحديثة
- يطلق عليها أيضاً نموذج ذرة بور المعدل
- دفعت أوجه قصور نموذج ذرة بور بالعلماء إلى إجراء تعديلات أساسية عليها.
- قامت النظرية الحديثة في تركيب الذرة على تعديلات أساسية في نموذج بور وكان أهم هذة التعديلات مايلي:
(1) الطبيعة المزدوجة للإلكترون (مبدأ دي براولي)
(2) مبدأ عدم التأكد لهايزنبرج
(3) النظرية الميكانيكية الموجية للذرة. (شرودنجر)

أولاً/ الطبيعة المزدوجة للإلكترون Dual Nature
- افترض بور أن الإلكترون مجرد جسيم مادي صغير سالب الشحنة، إلا أن التجارب أثبت أن للإلكترون طبيعة مزدوجة لأنه عبارة عن جسيم مادي له خواص موجية.
- يعرف بمبدأ دي براولي للطبيعة المزدوجة للألكترون.
- الطبيعة المزدوجة للإلكترون تنص على "الإلكترون جسيم مادي له خواص موجية"
ثانياً/ مبدأ عدم التأكد لهايزنبرج Uncertainity principle of Heisenberg
- افترض بور إمكانية تحديد موقع وسرعة الإلكترون معاً بدقة الإ أن هايزنبرج توصل عن طريق ميكانيكا الكم إلى استحالة حدوث ذلك عملياً.
- وبالتالي فأن التحدث بلغة الاحتمالات يكون هو الإقرب إلى الصواب وهو ما أطلق عليه مبدأ عد التأكد.
- مبدأ عدم التأكد لهايزنبرج ينص على :
" يستحيل عملياً تحديد موقع وسرعة الإلكترون معاً بدقة، وأن هذا يخضع لقوانين الاحتمالات".
ثالثاً/ النظرية الميكانيكة الموجية للذرة ( المعادلة الموجية لشرودنجر)
تمكن العالم النمساوي شرودنجر Schrodinger في عام 1926م بناءً على أفكار بلانك وأينشتين ودي براولي وهايزنبرج من:
(1) تأسيس النظرية الميكانيكة الموجية للذرة
(2) وضع المعادلة الموجية التى تطبق على حركة الإلكترون في الذرة والتى يمكن عن طريقها:
- تحديد مستويات الطاقة المسموح بها للألكترونات.
- تحديد المنطقة حول النواة التى يزداد فيها احتمال تواجد الإلكترونات في كل مستوى طاقة.
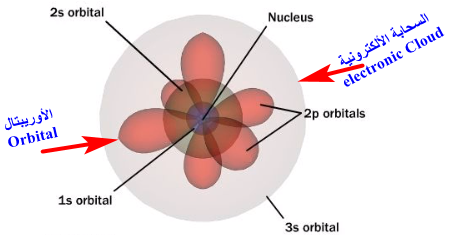
وقد غيرت المعادلة الموجية مفهومنا لحركة الإلكترونات حول النواة، فبعد أن كنا نعرف أن الإلكترونات تدور في مدارات محددة والفراغات بين هذة المدارات مناطق محرمة على الإلكترونات تم أستخدام مفهوم السحابة الألكترونية والأوربتال.
- السحابة الألكترونية هي مناطق الفراغ المحيط بالنواة والتى يحتمل وجود الألكترون فيها في كل الأتجاهات والابعاد.
- الأوربتال هي مناطق داخل السحابة الغلكترونية يزداد احتمال وجود الإلكترون فيها.
- أعطى الحل الرياضي للمعادلة الموجية لشرودنجر أربعة أعداد سميت بأعداد الكم.