تقسيم العناصر تبعًا للترتيب الإلكتروني
Classifying Elements by Electron Configuration
- من بين الجسيمات الذرّية الثلاثة الرئيسية في الذرة، نجد أن الإلكترون يقوم بالدور الأكثر أهمية في تحديد الخواص الفيزيائية والكيميائية للعنصر، حيث يعتمد ترتيب العناصر في الجدول الدوري على هذه الخواص.
- بالتالي، يجب أن تكون هناك علاقة ما بين الترتيبات الإلكترونية للعناصر وموقعها في الجدول الدوري.
- يمكن تقسيم العناصر إلى أربعة أنواع تبعًا لترتيباتها الإلكترونية.
- سوف تجد أن الاستعانة بالجدول الدوري ص 39-38 مفيدة جدا أثناء قراءتك هذه التقسيمات.
(1) الغازات النبيلة
The Noble Gases
- الغازات النبيلة The Noble Gases هي عناصر تمتلئ فيها تحت المستويات الخارجية (s) و (p) بالإلكترونات .
- تنتمي الغازات النبيلة إلى المجموعة 8A

- تُسمى عناصر هذه المجموعة أحيانًا بالغازات النبيلة لأنها لا تشترك في الكثير من التفاعلات الكيميائية.
- الترتيبات الإلكترونية لعناصر الغازات النبيلة الأربعة الأولى موضحة في ما يلي.

- لاحظ أن هذه العناصر ملأت تحت مستويات الطاقة s وp بالإلكترونات.
(2) العناصر المثالية
- تكون تحت مستويات الطاقة s أو p لهذه العناصر ممتلئة جزئياً بالإلكترونات.
- تُسمى العناصر المثالية عادة بعناصر المجموعة A.
- هناك ثلاث مجموعات من العناصر المثالية تمت تسميتها وهي عناصر المجموعة 1A وتُسمّى الفلزات القلوية وعناصر المجموعة 2A وتُسمّى الفلزات القلوية الأرضية، وعناصر اللافلزات للمجموعة 7A وتُسمى (الهالوجينات).
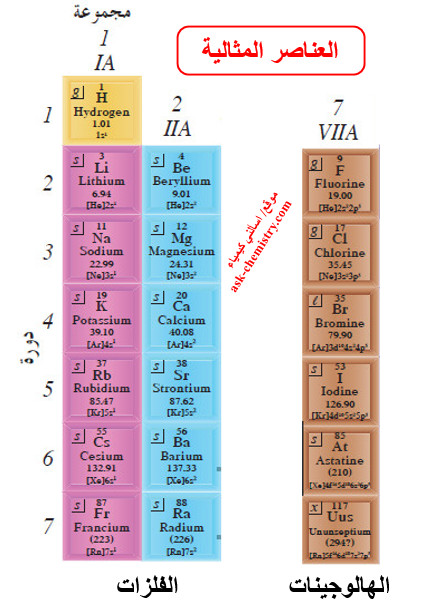
- عدد الإلكترونات في مستوى الطاقة الخارجي يمثل رقم المجموعة التي يقع فيها العنصر المثالي.
- على سبيل المثال، يحتوي كل من عناصر المجموعة 1A (الليثيوم، والصوديوم والبوتاسيوم، والروبيديوم، والسيزيوم، والفرانسيوم) على إلكترون واحد في مستوى الطاقة الخارجي.
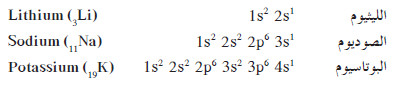
- يحتوي كل من الكربون والسيليكون والجرمانيوم في المجموعة 4A على 4 إلكترونات في مستوى الطاقة الخارجي .
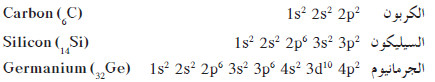
(3) العناصر الانتقالية
- العناصر الانتقالية The Transition Elements هي عناصر فلزية حيث يحتوي كل من تحت مستوى الطاقة s وتحت مستوى الطاقة d المجاور له على إلكترونات.
- تتميز العناصر الإنتقالية ، التي تُسمّى عناصر المجموعة B ، بإضافة الإلكترونات إلى أفلاك تحت مستوى الطاقة d.
(4) العناصر الانتقالية الداخلية
The Inner Transition Elements
- بصفة عامة ، هي عناصر فلزية حيث يحتوي كل من تحت مستوى الطاقة s وتحت مستوى f المجاور له على إلكترونات.
- تتميز العناصر الانتقالية الداخلية بإضافة الإلكترونات إلى أفلاك تحت مستوى الطاقة f.
- إذا تأملت كلا من الترتيبات الإلكترونية ومواقع العناصر في الجدول الدوري، ستجد أنه يمكن أن ينشأ نموذج آخر لتقسيم الجدول الدوري كالتالي:
