التدرج في نصف القطر الذري
- تعلمت في الدروس السابقة أنّ الذرّة ليس لها حدود واضحة تحدّد حجمها، لهذا لا يمكن قياس نصف قطر الذرّة بطريقة مباشرة ، ولكن هناك طرق عديدة لتقدير الأحجام النسبية للذرّات .
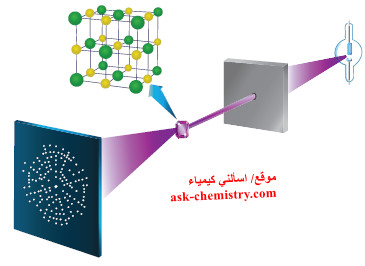
- فإذا تواجدت الذرات في تركيب بلوري صلب، فيمكن استخدام طريقة حيود الأشعة السينية (أشعة X) ، لتمدّنا بمسافة تقريبية بين الأنوية كما بالشكل التالي: ( يوضّح تحليل الصورة الناتجة من حيود الأشعّة السينية لـ NaCl المسافة بين نواتين في البناء والتركيب البلّوري).
- بالنسبة إلى العناصر التي توجد على هيئة جزيئات ثنائية الذرة، فإنّه يمكن تقدير المسافة بين أنوية الذرّات المرتبطة في الجزيء.
- نصف قطر الذرّة Atomic Radius هو نصف المسافة بين نواتي ذرتين متماثلتين (نوع واحد) في جزيء ثنائي الذرة.
- انظر الشكل التالي الذي يوضح المسافة بين الأنوية في جزيئات ثنائية الذرة لسبعة عناصر.
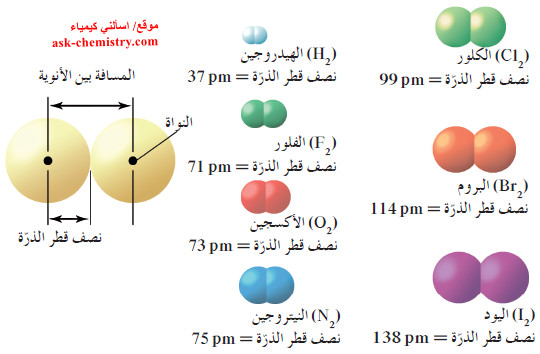
- تساوي المسافة بين الأنوية في جزيء البروم Br2 ثنائي الذرّة 228pm
1pm = 1 picometer = 10-12 m
- ولأن نصف القطر الذرّي يساوي نصف المسافة بين الأنوية ، فإن نصف قطر ذرة البروم يساوي 114pm.
- يوضح الشكل التالي أنصاف الأقطار الذرية لمعظم العناصر المثالية.
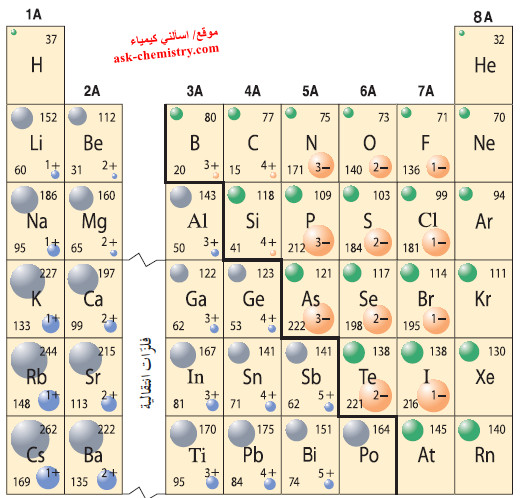
- تذكر أن نصف قطر الذرة لعنصر ما يدل على حجمها النسبي.
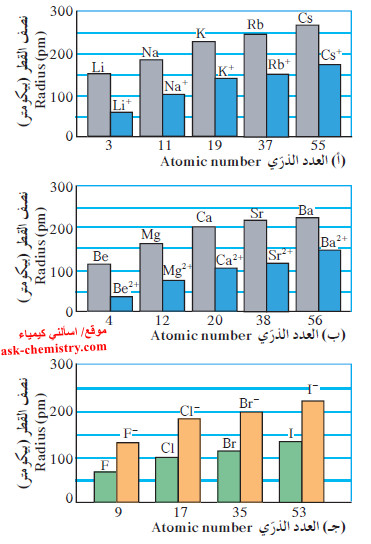
(1) تدرج نصف القطر الذري في المجموعات
- بصفة عامة ، يزداد الحجم الذري (نصف القطر الذري) كلما انتقلت إلى أسفل المجموعة في الجدول الدوري ضمن مجموعة ما.
- تضاف الإلكترونات إلى مستويات الطاقة الرئيسية الأعلى بالتتابع.
- يصبح المدار الخارجي أكبر كلما تحركت إلى أسفل في المجموعة.
- تزداد درجة حجب النواة نتيجة امتلاء الأفلاك المتتالية بين النواة والمدار الخارجي.
- على الرغم من أنه يمكنك أن تتوقع أن الزيادة في الشحنة على النواة من شأنها جذب الإلكترونات الخارجية ، وبالتالي انكماش حجم الذرّة، إلا أن ذلك لا يحدث.
- الزيادة الكبيرة في المسافة بين النواة والإلكترونات الخارجية تتغلب على تأثير الانكماش نتيجة زيادة الشحنة على النواة ، وتكون المحصلة النهائية ازدياد الحجم الذرّي.
- توضح الأعمدة في الرسم البياني التالي كيفية تزايد الحجم الذرّي (نصف القطر الذري) كلما اتجهنا إلى أسفل في المجموعات 1A (الفلزات القلوية) و 2A (الفلزات القلوية الأرضية) و7A (الهالوجينات).
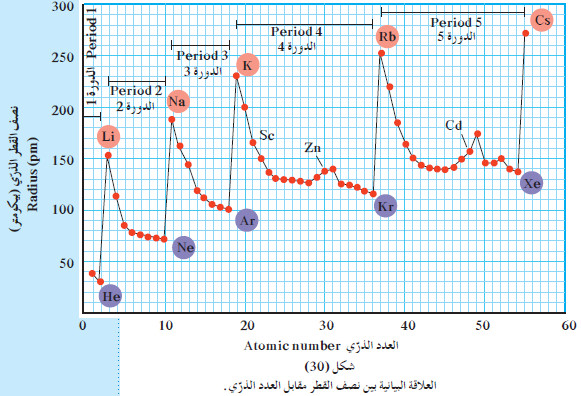
(2) تدرج نصف القطر الذري في الدورات
- بصفة عامة ، يقل الحجم الذري (نصف القطر الذري) كلما تحركت من اليسار إلى اليمين عبر الدورة.
- بتقدمك من اليسار إلى اليمين عبر الدورة الواحدة ، يظل مستوى الطاقة الرئيسي نفسه ، ويزيد كل عنصر عن العنصر الذي يسبقه بالكترون واحد وبروتون واحد.
- هذا يعني أنّ الإلكترونات تضاف إلى مستوى الطاقة الرئيسي نفسه، وتحدث من جهة أخرى زيادة متتالية في شحنة النواة.
- وبما أن إلكترونات تحت مستوى الطاقة لا تحجب بعضها بعضاً عن النواة بشكل جيّد، فإن شحنة النواة الفعالة التي يتعرض لها أي من الإلكترونات في تحت مستوى الطاقة تزداد.
- تؤدي هذه الزيادة في شحنة النواة إلى تجاذب أكبر لإلكترونات تحت مستوى الطاقة الخارجي عندما تتحرك عبر الدورة من اليسار إلى اليمين.
- ونتيجة لذلك، يتم سحب الإلكترونات الخارجية إلى مسافة أقرب إلى النواة ، ولهذا السبب يحدث تناقص في حجم الذرّة.
- يوضح الشكل التالي العلاقة نصف القطر الذرّي مقابل العدد الذري.
(3) التدرج في الحجم الذري
- يقل هذا الاتجاه بوضوح في الدورات التي يكون فيها إلكترونات كثيرة في مستويات الطاقة الرئيسية الممتلئة بين النواة والإلكترونات
الخارجية.
- وذلك لأن الإلكترونات الموجودة في تحت مستويات الطاقة تقوم بحجب شحنة النواة الموجبة عن الإلكترونات الخارجية.
- من ناحية أخرى، فإنّه في أي دورة يكون عدد الإلكترونات بين النواة والإلكترونات الخارجية ثابتًا لكل العناصر نتيجة لذلك، يكون تأثير حجب هذه الإلكترونات على النواة ثابتاً داخل الدورة.
- يلخص التدرّج في الحجم الذرّي خلال الدورة والمجموعة في الجدول الدوري.
