تكوين المركبات الأيونية
- تحمل الأنيونات والكاتيونات شحنات متضادّة وتنجذب إلى بعضها بقوى تجاذب إلكتروستاتيكية. قوى التجاذب التي تربط هذه الأيونات المختلفة في الشحنة تسمى بالروابط الأيونية Ionic Bonds.
- أما المركبات المكونة من مجموعات متعادلة كهربائياً من الأيونات المرتبطة ببعضها بقوى إلكتروستاتيكية، فهي تُعرف بالمركبات الأيونية.
- في أي عينة من مركب أيوني ، نجد أنّ الشحنات الموجبة الكلية للكاتيونات يجب أن تساوي الشحنات السالبة الكلية للأنيونات ، أي أنّ عدد الشحنات الموجبة يجب أن يساوي عدد الشحنات السالبة.
(أ) الرابطة الأيونية بين الصوديوم والكلور
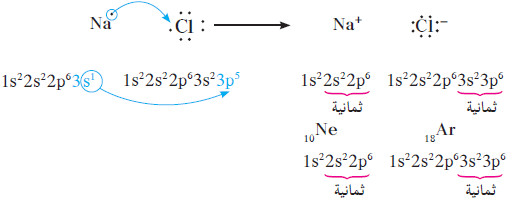
- يشكل كلوريد الصوديوم (ملح الطعام) مثالاً بسيطاً على كيفية تكوين الروابط الأيونية.
- فإذا نظرنا إلى التفاعل الذي يحدث بین ذرة الصوديوم وذرة الكلور ، نجد أن للصوديوم إلكترون تكافؤ واحد ، ويمكن أن يفقده بسهولة (إذا فقدت ذرّة الصوديوم إلكترون تكافؤها فإنّها تصل إلى الترتيب الإلكتروني الثابت لغاز النيون).
- أما الكلور ، فله سبعة إلكترونات تكافؤ ومن السهل أن يكتسب إلكترونا واحدًا إذا اكتسبت ذرة الكلور إلكترون تكافؤ واحدًا ، فإنّها تصل إلى الترتيب الإلكتروني الثابت لغاز الأرجون.
- لذلك، عندما يتفاعل الصوديوم مع الكلور لتكوين مركب ، تعطي ذرة الصوديوم إلكترون تكافؤها لذرّة الكلور.
- بالتالي ، يجب أن تتفاعل ذرة واحدة من الصوديوم مع ذرة واحدة من الكلور لإنتاج كاتيون صوديوم +Na واحد وأنيون كلوريد -Cl واحد ، ما يؤدي إلى تجاذب الشحنات المتعاكسة لتكوين كلوريد الصوديوم.
- تمثل الصيغة الكيميائية لكلوريد الصوديوم (NaCl) وحدة الصيغة، وهي تدل على أقل نسبة عددية صحيحة من الكاتيونات إلى الأنيونات لأي عينة من مركب أيوني.
- توضح الصيغة NaCl أن وحدة الصيغة الواحدة لكلوريد الصوديوم تحتوي على كاتيون صوديوم واحد وأنيون كلوريد واحد.
(2) الرابطة الأيونية بين البروم والألومنيوم
- يوضح الشكل التالي تفاعل البروم مع الألمنيوم لتكوين مركب بروميد الألمنيوم، حيث تفقد كلّ ذرّة المنيوم ثلاثة إلكترونات تكافؤ.

- كذلك، نجد أن كل ذرّة بروم تحوي سبعة إلكترونات تكافؤ ، وتكتسب بسهولة إلكترونا واحدًا إضافيا.
- لذلك، عندما يتفاعل الألمنيوم والبروم، تتحد كل ثلاث ذرات بروم مع ذرة ألمنيوم واحدة وتصبح صيغة المركب المتعادل الناتج AlBr3.
- بذلك ، يتضح مما سبق أن النسبة التي يجب أن يتفاعل فيها عنصران لتكوين مادة أيونية تتحدد بعدد الإلكترونات التي يجب أن تفقدها أو تكتسبها الذرّات المتفاعلة للوصول إلى ترتيب إلكتروني ثابت.