صيغ المواد الأيونية المتكونة بين الماغنسيوم والنيتروجين
- يجب كتابة الترتيب الإلكتروني النقطي لكلّ ذرّة في المركب.
- تفقد ذرّات الفلزات إلكترونات تكافؤها عند تكوينها لمركب أيوني، في حين تكتسب ذرّات اللافلزات إلكترونات.
- يجب استخدام ذرّات كافية من كلّ عنصر في الصيغة بحيث تتساوى الإلكترونات المفقودة مع الإلكترونات المكتسبة.
- ابدأ بالذرات 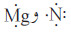 تحتاج كل ذرّة نيتروجين إلى اكتساب ثلاثة إلكترونات للحصول على ترتيب ثماني الإلكترونات ، في حين تفقد كل ذرة مغنيسيوم إلكترونين فقط لتصل إلى الترتيب الإلكتروني لغاز نبيل.
تحتاج كل ذرّة نيتروجين إلى اكتساب ثلاثة إلكترونات للحصول على ترتيب ثماني الإلكترونات ، في حين تفقد كل ذرة مغنيسيوم إلكترونين فقط لتصل إلى الترتيب الإلكتروني لغاز نبيل.
- لكي يكون المركب متعادلاً ، يتطلب ذلك ثلاث ذرات مغنيسيوم لكل ذرتي نيتروجين.

- صيغة المركب المتكوّن (نيتريد المغنيسيوم) هي Mg3N2.
- نجد أن عدد الإلكترونات المكتسبة بواسطة اللافلز تعادل عدد الإلكترونات المفقودة بواسطة الفلز.
- بالإضافة إلى ذلك، فإن قسمة الصيغ الناتجة على عدد صحيح لا تؤدي إلى اختصار تلك الصيغ، وبذلك فإنّ الصيغة Mg3N2 صحيحة.