خواص المركبات الأيونية
- عند درجة حرارة الغرفة، تكون جميع المركبات الأيونية مواد صلبة بلورية.
يُظهر الشكل التالي الجمال المدهش لبلورات بعض المركبات الأيونية.

- تترتب الأيونات المكوّنة في هذه البلورات في نماذج ثلاثية الأبعاد متكرّرة، ويُعتبر تركيب بلورة كلوريد الصوديوم مثالًا نموذجيًّا حيث يحاط كلّ كاتيون صوديوم بستة أنيونات كلوريد، وكلّ أيون كلوريد بستة كاتيونات صوديوم.
- في هذا الترتيب ، ينجذب كل أنيون بقوّة إلى الأيونات المتجاورة ، وبذلك يقل التنافر إلى أقل درجة ممكنة.
بمعنى آخر، عند تكوّن البلورة، تُرتّب الأيونات نفسها بحيث تزيد من التجاذب إلى الحد الأقصى، وتقلص من التنافر إلى الحد الأدنى.
- تؤدي قوى التجاذب الكبيرة إلى تركيب ثابت جداً، ما يعكس حقيقة أن كلوريد الصوديوم والمركبات الأيونية تتميّز ، بصفة عامة، بدرجات انصهار عالية.
(1) عدد التناسق Coordination Number
- عدد التناسق لأيون عنصر أو ذرّته هو الرقم الدال على عدد الأيونات التي تحيط هذا الأيون أو هذه الذرة بصفة مميزة وتلامسه وُضعت أساسيات ونظريات علم البلورات وبنائها في القرن التاسع عشر.
- أثبتت الدراسات المتتالية التي أجريت في مطلع القرن العشرين والتي استخدمت فيها الأشعة السينية أن فرضية وجود الشبكات البلورية صحيح تمام الصحة.
- تتوقف الخواص الداخلية للبلورات على بناء ذرات أو أيونات العناصر المكونة للبلورات وترتيبها ترتيباً هندسياً منظماً في الأبعاد الثلاثة.
- من أهم خواص العناصر: عدد التناسق ونوع الرابطة الموجودة بين أيونات تلك العناصر.
- أكثر أنواع الشبكات البلورية انتشاراً هي:
- الشبكة المكعبة البسيطة
- الشبكة المكعبة متمركزة الحجم
- الشبكة المكعبة متمركزة الوجه

(2) توصيل التيار الكهربائي
- توصل المواد الأيونية التيار الكهربائي وهي في الحالة المنصهرة.
- عندما يصهر كلوريد الصوديوم (درجة انصهاره حوالي 800C°) ، ينكسر الترتيب المنظم للبلورة كما هو موضح في الشكل التالي:
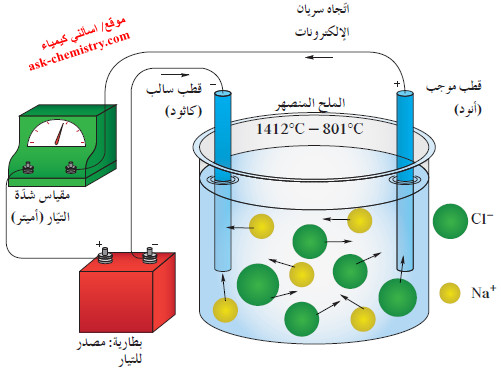
- عندما يُطبق جهد كهربائي عبر هذه الكتلة المنصهرة لكلوريد الصوديوم، تتحرّك الكاتيونات بحرية نحو الكاثود ، فيما تتجه الأنيونات نحو الأنود.
- تتسبب حركة هذه الأيونات في سريان التيار الكهربائي بين الأقطاب خلال سلك التوصيل الخارجي للدائرة.
- للسبب نفسه، توصل المركبات الأيونية التيار الكهربائي عندما تذاب في الماء، وذلك لأن الأيونات تتحرك بحرية في المحلول المائي.