الروابط التساهمية الأحادية Single Covalent Bonds
- تعد بعض الأملاح مثل كلوريد الصوديوم NaCl، مواد صلبة متبلرة ذي درجات انصهار مرتفعة، من ناحية أخرى، هناك مركبات لها خواص مختلفة للغاية.
- على سبيل المثال، يتواجد مركب كلوريد الهيدروجين HCl کغاز على درجة حرارة الغرفة، في حين يتواجد الماء H2O كسائل عند درجة الحرارة نفسها . يختلف هذان المركبان إلى حد كبير عن الأملاح لدرجة أنك قد تشكّ في أنّ الروابط بين ذرّات كل من مركب HCl ، أو H2O لا تتكوّن عن طريق الجذب الإلكتروستاتيكي ، كالروابط التي تتكوّن في المركبات الأيونية (روابط إلكتروستاتيكية).
- هذه الشكوك صائبة، فمثل هذه المركبات (HCl و H2O) لیست أيونية ، لأن ذرّاتها لا تفقد أو تكتسب إلكترونات كما يحدث في تفاعل الصوديوم مع الكلور. عوضًا عن ذلك، تحدث بين ذرات هذين المركبين رابطة بين الإلكترونات تشبه لعبة شدّ الحبل بحيث تبقى الذرتان
المشتركتان في هذه الرابطة على مسافة من بعضهما بعضًا. تنجذب إلكترونات الرابطة بدرجة أكبر أو أقل لإحدى الذرتين طبقا لنوع الذرّة.
- سوف تتعرف الآن الذرّات التي تشارك الإلكترونات في تكوين نوع مختلف من الرابطة يسمّى بـ (الرابطة التساهمية) Covalent Bond.
تكوين الرابطة التساهمية الأحادية
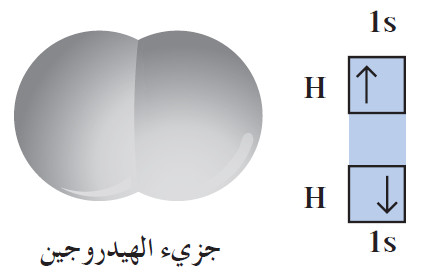
- لكي نبدأ الشرح للرابطة التساهمية فلنأخذ كمثال تكوين جزيء من ذرّتي هيدروجين.
- كل ذرّة هيدروجين لها إلكترون تكافؤ واحد، وبذلك يتقاسم زوج من ذرّات الهيدروجين إلكتروني التكافؤ لتكوين جزيء الهيدروجين ثنائي الذرّية (أي تساهم كلّ ذرّة بإلكترون واحد لتكوين الرابطة في الجزيء).
- تكمل كلّ ذرّة هيدروجين في هذا الجزيء غلاف تكافؤها من خلال مشاركة الإلكترون مع الذرّة الأخرى، لتصل إلى الترتيب الإلكتروني للغاز النبيل «الهيليوم»، الذي يحتوي على إلكترونين.
- بذلك، تكوّن ذرّتا الهيدروجين رابطة تساهمية أحادية Single Covalent Bond حيث تتقاسم الذرتان زوجًا واحدًا من الإلكترونات.
- يوضّح الشكل التالي تكوين هذه الرابطة في ضوء الأفلاك الذرّية.
- عند كتابة صيغة الرابطة التساهمية ، يمثل زوج الإلكترونات بخط كما في صيغة جزيء الهيدروجين H-H . ويسمى تمثيل الجزيئات في هذه الصورة بالصيغ البنائية Structural Formulas، وهي صيغ كيميائية توضح ترتيب الذرّات في الجزيئات والأيونات عديدة الذرّات . كلّ خط بين الذرّات في الصيغة البنائية يشير إلى زوج إلكترونات تساهمية تم التشارك في ما بينها.
- بالنظر إلى جزيء الهيدروجين ، يمكنك أن ترى أن هناك اختلافا بين صيغ المركبات الأيونية والمركبات التساهمية، فالصيغ الكيميائية للمركبات الأيونية تصف وحدات الصيغة، في حين أن الصيغ الكيميائية للمركبات التساهمية تمثل جزيئات.
- لا تملك المركبات الأيونية صيغاً جزيئية خاصة بها، لأنّها لا تتكوّن من جزيئات.
- تمثل الصيغة الكيميائية CuO مثلاً أقل وحدة متعادلة كهربائياً لأكسيد النحاس (II).
- على النقيض من ذلك، تتواجد جزيئات الهيدروجين المنفردة فعلياً في الحالة الغازية، ويحتوي كل جزيء على ذرّتي هيدروجين مترابطتين معاً برابطة تساهمية . على ذلك، فإنّ الصيغة الجزيئية لجزيء الهيدروجين هي H2 تعكس الصيغة الصحيحة للمركبات الجزيئية العدد الحقيقي للذرّات في كل جزيء، وليس من الضروري أن تكون الأعداد المكتوبة أسفل الذرّات في الجزيء أصغر النسب العددية الصحيحة كما هي الحال في المركبات الأيونية .
- يعرض الشكل التالي بعض الاختلافات الأساسية بين المركبات الأيونية والتساهمية مستعيناً بكلوريد الصوديوم والماء كأمثلة:


تطبيق قاعدة الثمانية
- ترتبط بعض ذرات العناصر اللافلزية في المجموعات 4A - 5A - 6A - 7A من الجدول الدوري ببعضها بعضًا، فتتكوّن روابط تساهمية.
- لخص العالم الكيميائي جيلبرت لويس هذا الاتجاه في صياغته لقاعدة الثمانية الخاصة بالرابطة التساهمية ، وهي:
تحدث المساهمة بالإلكترونات إذا اكتسبت الذرّات المشاركة في تكوين الرابطة التساهمية الترتيبات الإلكترونية للغازات النبيلة (أي يصبح هناك ثمانية إلكترونات في غلاف تكافؤ كلّ ذرّة باستثناء الهيليوم الذي له إلكترونا تكافؤ اثنان.
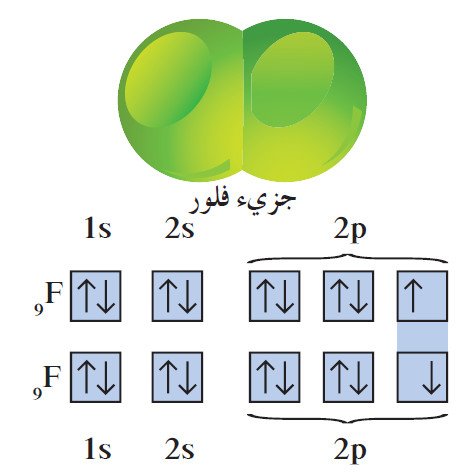
- تكون الهالوجينات روابط تساهمية أحادية في جزيئاتها ثنائية الذرّة. يشكل جزيء الفلور مثالاً على ذلك.
الرابطة التساهمية فى جزئ الفلور
- كل ذرة فلور لها سبعة إلكترونات تكافؤ ، وتحتاج إلى إلكترون إضافي لتصل إلى الترتيب الإلكتروني للغاز النبيل. لذلك تتقاسم ذرّتان من الفلور زوجاً من الإلكترونات فتتكوّن رابطة تساهمية أحادية.
- يكتمل غلاف تكافؤ كلّ ذرّة فلور بثمانية إلكترونات لتصل إلى الترتيب الإلكتروني لغاز النيون . ويُظهرالتالي تكوّن الرابطة التساهمية في جزيء الفلور في ضوء الأفلاك الذرية.
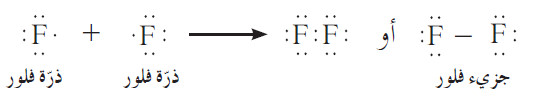
- في جزيء الفلور، تساهم كلّ ذرّة فلور بإلكترون واحد لتكمل الثمانية.
- لاحظ أن ذرّتي الفلور تتقاسمان زوجًا واحدًا فقط من إلكترونات التكافؤ . وتسمّى أزواج إلكترونات التكافؤ التي لم تساهم بين الذرّات بأزواج الإلكترونات غير المشاركة Unshared Electron Pairs أو بالأزواج غير المرتبطة.
توضيح الرابطة التساهمية الأحادية في بعض الجزيئات
- يمكنك كتابة الصيغ الإلكترونية النقطية لجزيئات المركبات بالطريقة نفسها التي استخدمتها لكتابة جزيئات العناصر ثنائية الذرّة.
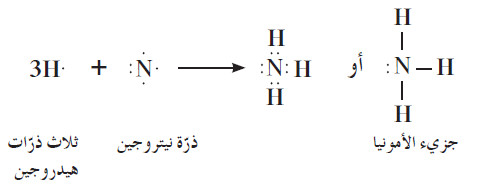
- لنأخذ أمثلة الماء والأمونيا الموضحة في الشكل التالي:
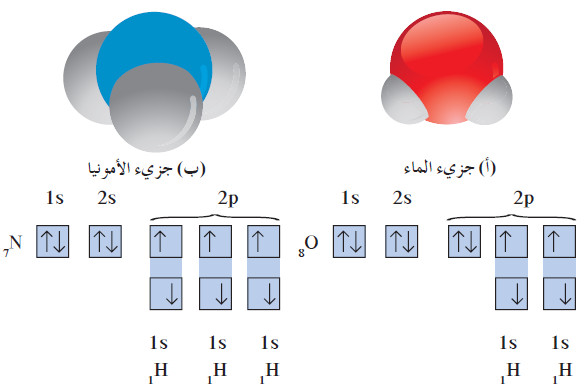
(أ) في جزيء الماء ، تكون ذرتا الهيدروجين روابط تساهمية أحادية مع ذرة أكسجين واحدة.
(ب) في جزيء الأمونيا ، تكون ذرات الهيدروجين الثلاث روابط تساهمية أحادية مع ذرة نيتروجين واحدة.
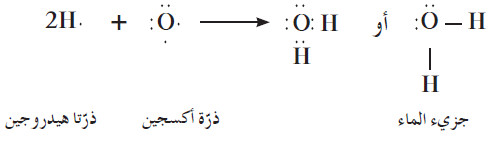
- الماء H2O جزيء ثلاثي الذرّات، وفيه رابطتان تساهميتان أحاديتان . تساهم كل من ذرّتي الهيدروجين بإلكترون مع ذرّة أكسجين واحدة بحيث تصل جميعها إلى الترتيب الإلكتروني للغاز النبيل.
- كما ترى في الترتيب الإلكتروني النقطي الموضح في المعادلة أدناه ، فإن ذرّة الأكسجين في جزيء الماء لها زوجان من إلكترونات التكافؤ غير التساهمية أو غير المرتبطة.
- يمكنك كتابة الصيغة الإلكترونية النقطية للأمونيا NH3 بالطريقة نفسها، ويحتوي جزيء الأمونيا على زوج واحد من إلكترونات التكافؤ غير
التساهمية.