أمثلة على الروابط التساهمية الأحادية
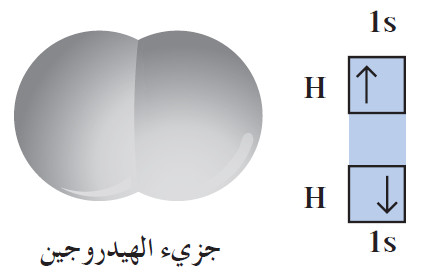
(1) الرابطة التساهمية فى جزئ الهيدروجين
- كل ذرّة هيدروجين لها إلكترون تكافؤ واحد، وبذلك يتقاسم زوج من ذرّات الهيدروجين إلكتروني التكافؤ لتكوين جزيء الهيدروجين ثنائي الذرّية (أي تساهم كلّ ذرّة بإلكترون واحد لتكوين الرابطة في الجزيء).
- تكمل كلّ ذرّة هيدروجين في هذا الجزيء غلاف تكافؤها من خلال مشاركة الإلكترون مع الذرّة الأخرى، لتصل إلى الترتيب الإلكتروني للغاز النبيل «الهيليوم»، الذي يحتوي على إلكترونين.
- بذلك، تكوّن ذرّتا الهيدروجين رابطة تساهمية أحادية Single Covalent Bond حيث تتقاسم الذرتان زوجًا واحدًا من الإلكترونات.
- يوضّح الشكل التالي تكوين هذه الرابطة في ضوء الأفلاك الذرّية.
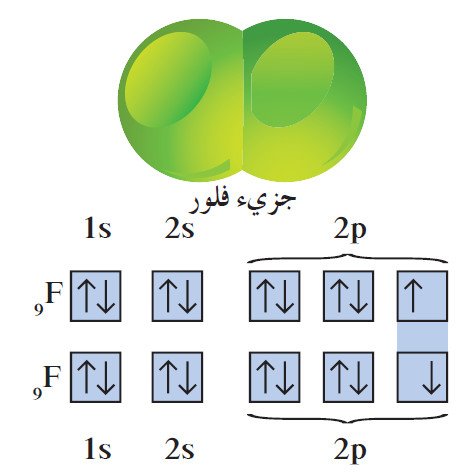
(2) الرابطة التساهمية فى جزئ الفلور
- كل ذرة فلور لها سبعة إلكترونات تكافؤ ، وتحتاج إلى إلكترون إضافي لتصل إلى الترتيب الإلكتروني للغاز النبيل. لذلك تتقاسم ذرّتان من الفلور زوجاً من الإلكترونات فتتكوّن رابطة تساهمية أحادية.
- يكتمل غلاف تكافؤ كلّ ذرّة فلور بثمانية إلكترونات لتصل إلى الترتيب الإلكتروني لغاز النيون . ويُظهرالتالي تكوّن الرابطة التساهمية في جزيء الفلور في ضوء الأفلاك الذرية.
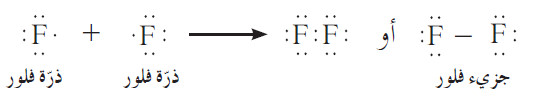
- في جزيء الفلور، تساهم كلّ ذرّة فلور بإلكترون واحد لتكمل الثمانية.
- لاحظ أن ذرّتي الفلور تتقاسمان زوجًا واحدًا فقط من إلكترونات التكافؤ . وتسمّى أزواج إلكترونات التكافؤ التي لم تساهم بين الذرّات بأزواج الإلكترونات غير المشاركة Unshared Electron Pairs أو بالأزواج غير المرتبطة.
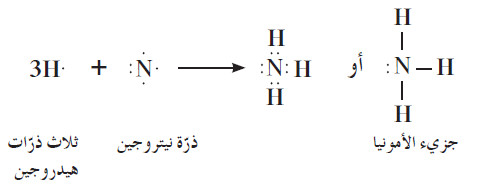
(3) الرابطة التساهمية في جزئ الماء وجزئ الأمونيا
- يمكنك كتابة الصيغ الإلكترونية النقطية لجزيئات المركبات بالطريقة نفسها التي استخدمتها لكتابة جزيئات العناصر ثنائية الذرّة.
- لنأخذ أمثلة الماء والأمونيا الموضحة في الشكل التالي:
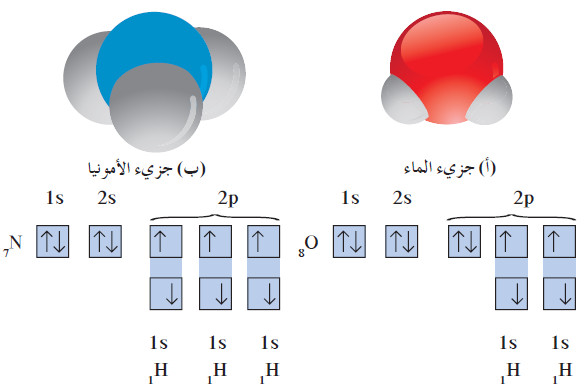
(أ) في جزيء الماء ، تكون ذرتا الهيدروجين روابط تساهمية أحادية مع ذرة أكسجين واحدة.
(ب) في جزيء الأمونيا ، تكون ذرات الهيدروجين الثلاث روابط تساهمية أحادية مع ذرة نيتروجين واحدة.
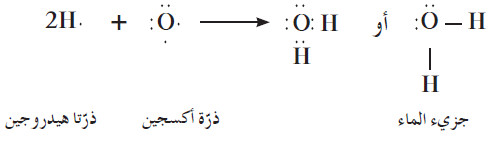
- الماء H2O جزيء ثلاثي الذرّات، وفيه رابطتان تساهميتان أحاديتان . تساهم كل من ذرّتي الهيدروجين بإلكترون مع ذرّة أكسجين واحدة بحيث تصل جميعها إلى الترتيب الإلكتروني للغاز النبيل.
- كما ترى في الترتيب الإلكتروني النقطي الموضح في المعادلة أدناه ، فإن ذرّة الأكسجين في جزيء الماء لها زوجان من إلكترونات التكافؤ غير التساهمية أو غير المرتبطة.
- يمكنك كتابة الصيغة الإلكترونية النقطية للأمونيا NH3 بالطريقة نفسها، ويحتوي جزيء الأمونيا على زوج واحد من إلكترونات التكافؤ غير
التساهمية.