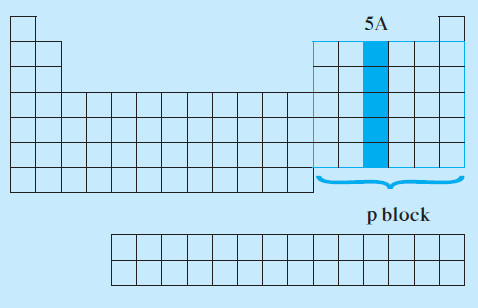
خواص عناصر المجموعة 5A
- توجد عناصر المجموعة 5A في المنطقة اليمنى من الجدول الدوري.
- تحتوي على العناصر التي تقع إلكتروناتها الخارجية في تحت المستوى (np3).
أولاً/ النيتروجين Nitrogen
(أ) وجوده
- النيتروجين العنصر الأول في المجموعة 5A هو لافلز وغاز عند درجة حرارة الغرفة.
- وبترتيب تنازلي ، نجد أن العناصر التي تلي النيتروجين في المجموعة هي الفوسفور، وهو لافلز صلب، والزرنيخ والأنتيمون ، وهما أشباه فلزات ، والعنصر الأخير ، البزموت ، هو فلز.
- النيتروجين عنصر آخر من العناصر الرئيسية الموجودة في الكائنات الحية، وعلى الرغم من أن 80% من الهواء الذي نستنشقه عبارة عن نيتروجين ، لا يستطيع الجسم الاستفادة منه في هذه الصورة.
- لحسن الحظ، البكتيريا في التربة الزراعية تقوم بتثبيت النيتروجين المثبتة لتركيب البروتينات ومركبات أخرى بيولوجية مهمة تحتوي على النيتروجين.
يُمكن فصل النيتروجين عن الهواء على نطاق تجاري بطريقتين، إحداهما التقطير التجزيئي للهواء المسال.
- نظرًا لكون النيتروجين المسال يغلي عند درجة أدنى من درجة غليان الأكسجين السائل، فإن النيتروجين يتصاعد أوّلًا من الخليط ويتم جمعه.
- الطريقة الثانية لفصل النيتروجين هي تمرير الهواء فوق فحم الكوك المسخّن لدرجة الاحمرار ، وهو غالبًا ما يكون فحماً نقياً.
- يتحد الكربون بالأكسجين ليكون ثاني أكسيد الكربون، في حين يبقى النيتروجين من دون تغيّر.
(ب) خواصه الفيزيائية
- النيتروجين غاز عديم اللون والرائحة والطعم ويتكون من جزيئات ثنائية الذرية N2 في الغلاف الجوي.
- كما أنّه شحيح الذوبان في الماء ولا يتفاعل بسهولة، ويغلي عند درجة 196Co- ويتجمد عند °210C- .
(جـ) استخداماته
- من أهم الاستخدامات الصناعية للنيتروجين الجوي هو تصنيع مركبين هما الأمونيا بطريقة هابر - بوش Haber - Bosch وحمض النيتريك بطريقة أوستوالد Ostwald .
- في طريقة هابر - بوش تُسخّن غازات النيتروجين والهيدروجين حتّى C°500 تحت ضغط kPa 103 × 6 في وجود الحديد كعامل حفّاز:
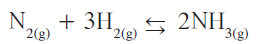
- من السهل إزالة غاز الأمونيا بالتبريد، وبذلك يتم فصله عن المتفاعلات الغازية المتبقية بالإسالة.
- يدخل سائل الأمونيا النقي كأحد مكونات منتجات تنظيف عديدة وكوسيلة تبريد وكأسمدة زراعية.
- يُستخدم حمض النيتريك في إنتاج الأسمدة الزراعية ،والصبغات وله دور مهم كمادة أولية في صناعة المتفجرات.

(د) خواصه الكيميائية
- التفاعل مع غاز الهيدروجين
يتحد النيتروجين بالهيدروجين عند درجات منخفضة نسبيًّا في وجود عامل حفاز وتحت ضغط مرتفع كما في المعادلة التالية:
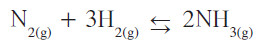
- التفاعل مع الأكسجين
يتحد غاز النيتروجين بالأكسجين ليتكوّن أكسيد النيتريك، ولكن لا يتم هذا التفاعل إلّا عند درجات حرارة عالية جدا (C° 3000) كما في المعادلة التالية:
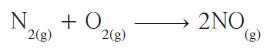
ثانياً/ الفوسفور Phosphorus
- يقوم الفوسفور بعدد من الوظائف المهمة والحسّاسة، فوحدات الفوسفات تلعب دورًا مهمًّا في بنية الـ DNA الوراثي الذي يُوجه التغيرات الكيميائية في خلايانا، وينقل المعلومات الوراثية من جيل إلى آخر .
- يوجد الفوسفور أيضًا في العظام والأسنان ، وفي الدهنيات الفوسفورية ATP وهي المواد التي تدخل في تركيب أغشية الخلايا .
- يوجد الفوسفور بصفة أساسية في شكل الصخور الفوسفاتية.
يُحضّر الفوسفور النقي كفوسفور أبيض وفوسفور أحمر.
- الفوسفور الأبيض نشيط جدًّا، في حين أن الفوسفور الأحمر أكثر ثباتًا ويُستخدم في صناعة أعواد الثقاب.

- يُحفظ الفوسفور الأبيض تحت سطح الماء عادة لمنع ملامسته للأكسجين والاشتعال تلقائيًا عند تعرضه للهواء الجوي.