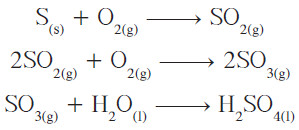خواص المجموعة 6A
- توجد عناصر المجموعة 6A في المنطقة اليمنى من الجدول الدوري.
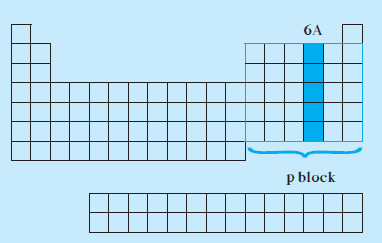
- تحتوي على العناصر التي تقع إلكتروناتها الخارجية في تحت المستوى (np4).
- عناصر المجموعة 6A هي والكبريت والسلينيوم والتيلوريوم والبولونيوم.
- الأكسجين هو غاز لافلز.
- الكبريت لافلز وهو مادة صلبة صفراء لامعة.
- السلينيوم والتيلوريوم كلاهما من المواد الصلبة وأشباه الفلزات.
- البولونيوم فلز مشع.
الأكسجين Oxygen
(أ) وجوده والخواص الفيزيائية
- الأكسجين هو غاز لافلز.
- الأكسجين هو العنصر الأكثر توفّرًا وهو يُمثل 50% بالكتلة من القشرة الأرضية و 60% بالكتلة من جسم الإنسان و 20% بالحجم من الهواء الذي نتنفسه.
- المصدر الطبيعي الرئيسي للأكسجين التجاري هو الهواء.
- نحصل على غاز الأكسجين النقي نسبيًّا بإسالة الهواء ثم تقطيره تجزيئيًّا ، فيتكثف الأكسجين عندما يبرد متحوّلًا إلى سائل أزرق في الحالة السائلة
- أكثر الاستخدامات التجارية لغاز الأكسجين هو عملية أكسدة الشوائب في الحديد عند صناعة الصلب.
- تستخدم فرق الإغاثة الطبية غاز الأكسجين لإنقاذ الضحايا الذين استنشقوا دخان الحرائق والذين تعرضوا للصدمات الكهربائية أو الغرق.
- يستخدم في بعض الحالات الطبية الحرجة، مثل الالتهاب الرئوي والتسمم بالغاز ، يحتاج المريض إلى استنشاق هواء غني بالأكسجين لمدة طويلة.
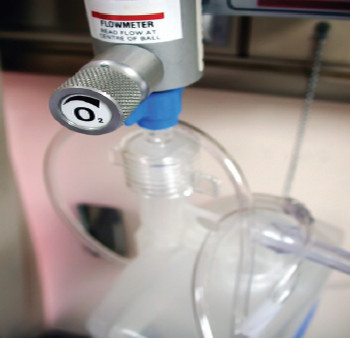
- لماذا توجد في الطائرات أسطوانات من غاز الأكسجين؟ توجد أسطوانات الأكسجين في الطائرات لأغراض السلامة في حالات الطوارئ وللاستخدام الطبي، حيث توفر الأكسجين للركاب والطيارين في حال انخفاض ضغط المقصورة أو عند الحاجة لأكسجين إضافي. يقل الضغط الجوي في الارتفاعات العالية لدرجة يصعب على الإنسان التنفس، لذا يتم توفير الأكسجين لضمان السلامة.
- الأوزون O3 هو شكل آخر للأكسجين ينتج عند تمرير شرارة كهربائية عبر الأكسجين، ويحدث ذلك عند حدوث العواصف الكهربائية الرعدية.
- كما يتكوّن الأوزون في طبقات الجو العليا للأرض بتأثير الأشعة فوق البنفسجية على الأكسجين.
- ويتكوّن الأوزون أيضًا بالقرب من مولدات الكهرباء ذات الجهد العالي.
- ويحمي الأوزون الكائنات الحية من الزيادة في الأشعة فوق البنفسجية الناتجة من الشمس.
(ب) خواصه الكيميائية
- تُسمّى عملية اتحاد المواد كيميائياً بالأكسجين بالأكسدة، وناتج تفاعل الأكسدة هو الأكسيد.
- يتكون نوعان من الأكاسيد بحسب كمية الأكسجين عند الاتحاد بالعنصر، وتختلف الأكاسيد في خواصها تبعاً لنوع العنصر وظروف التفاعل.
- عندما تكون كمية الأكسجين قليلة، تتكوّن الأكاسيد بحسب المعادلة التالية:
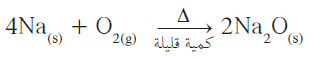
- عندما تكون كمّية الأكسجين وافرة ، تتكوّن فوق الأكاسيد بحسب المعادلة التالية:

الكبريت Sulfur
- الكبريت لا فلز وهو مادة صلبة لونها أصفر باهت ولا تذوب في الماء، وعرفت من العصور القديمة.
- يوجد الكبريت في ترسيبات ضخمة تقع تحت سطح الأرض.
- يُستخرَج الكبريت من الأرض باستخدام طريقة المهندس الألماني فراش Frasch.
- في هذه الطريقة تُحفر آبار تصل إلى الطبقة التي يوجد فيها الكبريت الخام ، ثمّ تُثبت فيها ثلاثة أنابيب متداخلة كما هو مبين في الشكل التالي:
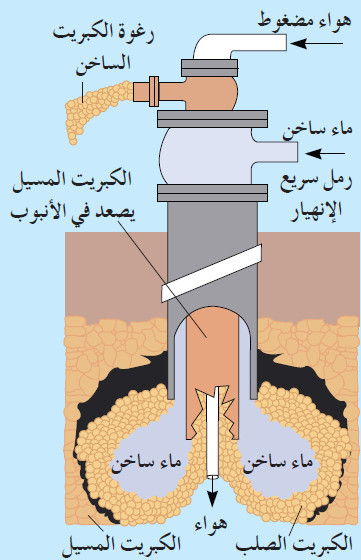
- يُضَح الماء الساخن تحت ضغط عال نسبيًّا إلى أسفل الأنبوب لصهر الكبريت ويصعد في الأنبوب الثالث على هيئة رغوة، وهي مزيج من الهواء والماء والكبريت المنصهر بواسطة هواء مضغوط يتم ضغطه في الأنبوب المركزي.
- يُضَح الكبريت المنصهر في خزانات كبيرة حيث يبرد ويجمد على شكل كتل ضخمة.
- نحصل أيضًا على الكبريت من كبريتيد الهيدروجين. وهو غاز سام ينتج عن تكرير البترول ويتميز برائحة البيض الفاسد.
- يتم حرق بعض من كبريتيد الهيدروجين في الهواء لتكوين ثاني أكسيد الكبريت الذي تتم معالجته بكمية زائدة من كبريتيد الهيدروجين لتكوين الكبريت كما تبين المعادلة التالية:

- يُعتبر الكبريت مادة خام مهمة جدًّا في الصناعات الكيميائية.
- فهو يُستخدم في تحضير مواد الطلاء والبلاستيك والأدوية والأصباغ.
- كما أنه عامل أساسي في عمليات تكرير البترول .
- لكن استخدامه الرئيسي هو في صناعة حمض الكبريتيك .
- يدخل نصف إنتاج العالم من حمض الكبريتيك في صناعة الأسمدة الزراعية، مثل كبريتات الأمونيوم والسوبر فوسفات.
- يُصنع حمض الكبريتيك في الوقت الحالي بطريقة التلامس.
- في هذه العملية يُحرق الكبريت أوّلاً في الهواء ليتكون غاز ثاني أكسيد الكبريت ، وهو غاز سام ذو رائحة مهيجة للأغشية المخاطية.
- وبعد ذلك ، يُمرَّر ثاني أكسيد الكبريت مع كمّية إضافية من الأكسجين من الهواء فوق عامل حفّاز من خماسي أكسيد الفانديوم الذي يُؤكسد ثاني أكسيد الكبريت إلى ثالث أكسيد الكبريت: