علاقة قانون بقاء الكتلة ووزن المعادلة الكيميائية
- عند وزن المعادلة الكيميائية لابد من تساوي عدد كل ذرة أو أيون عديد الذرات في كل من طرفي المعادلة لتتأكد من وزن المعادلة تحقيقاً لقانون بقاء الكتلة.
- المثال التالي لتوضيح العلاقة بين قانون بقاء الكتلة ووزن المعادلة الكيميائية:
مثال : يتفاعل الألمنيوم مع الأكسجين في الهواء ليكون طبقة رقيقة من أكسيد الألمنيوم تغطي الألمنيوم وتحميه من الأكسدة. زن معادلة هذا التفاعل:
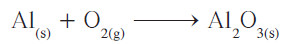
الحل
- طبق قواعد وزن المعادلات الكيميائية.
- زن أولاً عدد ذرات الألمنيوم في كل من طرفي المعادلة بوضع المعامل 2 أمام Al.
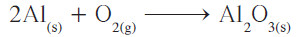
تظهر هنا مشكلة تتكرر كثيرًا في وزن المعادلات الكيميائية، ويُمكن تسميتها مشكلة الأعداد الزوجية والفردية، لأن أي معامل يوضع أمام O2 سوف يُعطي أعدادًا زوجية من ذرّات الأكسجين في الطرف الأيسر ، لأن هذا المعامل سوف يضرب باستمرار في رقم 2 (عدد ذرات الأكسجين في جزيء غاز الأكسجين).
- كيف يمكننا تحويل الرقم الفردي لذرات الأكسجين الموجود في الطرف الأيمن للمعادلة، إلى رقم زوجي لكي يتزن مع الرقم الزوجي لعدد ذرات الأكسجين في الطرف الأيسر؟ أسهل طريقة للوصول إلى ذلك هي وضع معامل زوجي 2 أمام صيغة Al2O3 لتحويل عدد ذرات الأكسجين الفردية إلى زوجية:
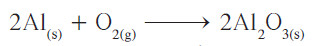
- أصبح عدد ذرات الأكسجين في الطرف الأيمن من المعادلة يُساوي 6 ذرّات، بينما في الطرف الأيسر ذرتين فقط، فيلزم وضع معامل 3 أمام O2 ، وكذلك تصحيح معامل الألمنيوم ليُصبح 4 بدلاً من 2.
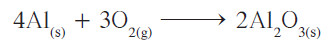
توضيح
- المعادلة تتبع قانون بقاء الكتلة حيث هناك أعداد متساوية من ذرات العناصر المتفاعلة والناتجة ، كذلك المعاملات في أبسط نسبة عددية صحيحة.