تفاعلات الترسيب Precipitation Reactions
- يحدث الترسيب عند خلط محلولين مائيين لملحين مختلفين.
- كاتيون الفلز لأحد الملحين يتحد مع الأنيون السالب للملح الآخر مكونا مركبًا أيونيًا جديدًا، لا يذوب في الماء.
- على سبيل المثال، عند خلط محلول نيترات الفضة المائي مع محلول كلوريد الصوديوم المائي، يتكوّن كلوريد الفضّة، وهو ملح لا يذوب في الماء، وفق التفاعل غير المتجانس التالي:
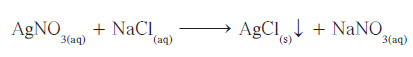
- نستطيع أن نكتب المعادلة الأيونية الكاملة التي تظهر جميع المواد الذائبة في صورتها المفككة بأيونات حرّة في المحلول، ونكتب صيغة كلوريد الفضّة في صورتها غير المفككة:

- يُمكن تبسيط المعادلة السابقة، وذلك بإزالة الأيونات المتفرجة Spectator Tons، وهي أيونات لا تشارك أو تتفاعل خلال تفاعل كيميائي مثل (Na و -NO3) ، فنحصل على المعادلة الأيونية النهائية، والتي تُشير إلى الجسيمات التي شاركت في التفاعل:
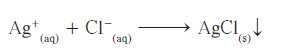
-عند كتابة المعادلات الأيونية النهائية الموزونة ، فإنه يجب وزن الشحنة الأيونية في جانبي المعادلة، وبالنظر إلى المعادلة السابقة، فإنّنا نجد أن الشحنة الأيونية النهائية على جانبي المعادلة تُساوي صفرًا.
مثال تفاعلات الترسيب والأيونات المتفرجة
عين الأيونات المتفرّجة واكتب المعادلة الأيونية النهائية الموزونة للتفاعلات التالية:
(أ)

(ب) اخلط محلولًا مائيًا من كلوريد الحديد (III) ومحلولا مائيًا من هيدروكسيد البوتاسيوم لتكوين راسب من هيدروكسيد الحديد (III) .
الحل
اكتب المعادلة الأيونية الكاملة لكلّ تفاعل مبيّنًا المركبات الأيونية الذائبة في صورة أيونات منفردة، والأيونات المائية التي تظهر على جانبي المعادلة في المتفاعلات والنواتج المتماثلة (هي أيونات متفرّجة). وبحذفها ، نحصل على المعادلة الأيونية النهائية ، والتي نستطيع وزنها بعد ذلك.
(أ) اكتب المعادلة الأيونية الكاملة:

- الأيون المتفرّج هو +Na ، والمعادلة الأيونية النهائية الموزونة هي:

(ب) اكتب المعادلة الأيونية الكاملة:
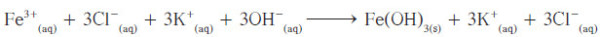
- الأيونات المتفرّجة هي -Cl و +K والمعادلة الأيونية النهائية الموزونة هي:
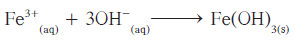
ملاحظات
- في كل معادلة أيونية نهائية موزونة، عدد الذرات ونوعها في الطرف الأيسر من المعادلة يُساوي عدد الذرّات ونوعها في الطرف الأيمن . وكذلك الشحنة النهائية لجميع المتفاعلات في الطرف الأيسر، تُساوي الشحنة النهائية لجميع النواتج في الطرف الأيمن.