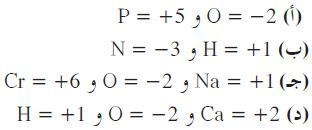أعداد التأكسد
- عدد التأكسد هو عدد موجب أو سالب ، يُنسب إلى الذرة طبقاً لمجموعة من القواعد.
- يُمكن أن يُعرف عدد التأكسد بأنه العدد الذي يمثل الشحنة الكهربائية الموجبة أو السالبة التي تحملها ذرّة العنصر في المركب أو الأيون.
- يُستعمل اصطلاح حالة التأكسد أيضًا بمعنى عدد التأكسد نفسه في المركبات الأيونية الثنائية ، مثل CaCl2 و NaCl.
- أعداد التأكسد للذرّات تساوي الشحنة الأيونية الموجودة على كلّ ذرّة، ومثال ذلك مركب كلوريد الصوديوم الذي يتكون من كاتيونات الصوديوم +Na وأنيونات الكلوريد -Cl، وبذلك يكون عدد تأكسد الصوديوم هو (1+) والكلوريد هو (1-).
- مع ملاحظة طريقة كتابة عدد التأكسد، وهو وضع الإشارة قبل العدد، ومثال ذلك الصوديوم في مركب NaCl له شحنة أيونية تُساوي (+1) وعدد تأكسد يُساوي (1+).
قواعد تحديد أعداد التأكسد
(1) في الأيونات وحيدة الذرة يكون للأيون عدد تأكسد مساو لعدد الشحنات التي يحملها الأيون.
- مثال: عدد تأكسد أيون البروميد -Br يُساوي (1-) ، وعدد تأكسد +Fe3 يُساوي (3+).
(2) في معظم المركبات التي تحوي الهيدروجين، يكون عدد التأكسد للهيدروجين مساويًا (1+)
- مثال: الماء H2O وحمض الهيدروكلوريك HCl وغاز الميثان CH4.
- تشذ عن هذه القاعدة عندما يتحد الهيدروجين بعناصر أقل سالبية كهربائية منه ، مثل الفلزات، كما في المركبات التالية NaH, CaH2 ,AlH3 حيث يكون عدد التأكسد للهيدروجين في هذه المركبات يُساوي (1-) .
(3) في معظم المركبات التي تحوي الأكسجين يكون عدد التأكسد لكل ذرة أكسجين مساويًا (2-)
- مثل: H3PO4 ، Na2O ، H2O
- لكن عندما يكون الأكسجين مرتبطاً بنفسه O=O يكون عدد تأكسده يُساوي صفرًا (0) .
- أما في البيروكسيدات Peroxides فيكون لكل ذرة أكسجين -O22 عدد تأكسد يُساوي (1-) ، مثل H2O2 و Na2O2 حيث إن أنيون البيروكسيد يحمل شحنتين سالبتين.
- هناك حالة شاذة يكون فيها عدد التأكسد (2+) ، كما في مركب OF2 حيث إن الفلور له سالبية كهربائية أكبر من الأكسجين.
(4) في حالة ذرة غير متحدة أو ذرة في جزيء أحد العناصر ، تُعطي عادة عدد تأكسد مساويًا للصفر (0).
مثال: ذرات الصوديوم في فاز الصوديوم Na أو ذرّات النيتروجين في غاز النيتروجين N2، فإن عدد التأكسد لجميع الذرّات يُساوي صفرًا (0).
(5) مجموع أعداد التأكسد لجميع الذرّات في مركب متعادل ، يُساوي صفرًا.
(6) المجموع الجبري لأعداد التأكسد في الأيون المتعدّد الذرات يجب أن يُساوي شحنة الأيون.
- باستخدام القاعدتين 5 و 6 يُمكن معرفة عدد التأكسد لبعض الذرات التي لا يمكن معرفة عدد تأكسدها باستخدام القواعد السابقة.
- مثال على ذلك، في حمض الكبريتيك H2SO4 يكون عدد التأكسد للكبريت يُساوي (6+) ، لأنّ كلّ ذرّة أكسجين عدد تأكسدها (2-) وكل ذرة هيدروجين (1+) ، وحيث إنّ الجزيء متعادل فيكون:
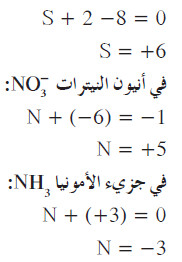
مثال (1) : ما هو عدد التأكسد لكل ذرة في المركبات التالية:
(أ) SO2
(ب) -CO32
(جـ) H2SO4
الحل:
- استخدم القواعد السابقة لتحديد أعداد التأكسد:
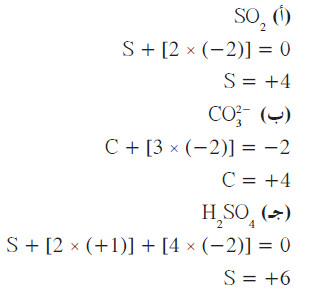
ملاحظات:
- النتائج متفقة مع قواعد تحديد أعداد التأكسد ، فقد استخدمت القاعدة رقم (2) لإيجاد عدد تأكسد ذرة الهيدروجين في المركب H2SO4
- استخدمت القاعدة رقم (3) لإيجاد عدد تأكسد ذرة الأكسجين للمركبات الثلاثة.
- استخدمت القاعدة رقم (5) لإيجاد عدد تأكسد ذرة الكبريت في المركب SO2 ، والمركب H2SO4.
- استخدمت القاعدة رقم (6) لإيجاد عدد تأكسد ذرّة الكربون في الأنيون -CO32 وأيضًا حاصل جمع أعداد التأكسد أدى إلى الشحنة النهائية للأيون والمركبين المتعادلين.
مثال (2): عين عدد التأكسد لكل عنصر في المواد التالية:
(أ) -SO32
(ب) O2
(جـ) 3(Al2(SO4
(د) Na2O2
الحل:
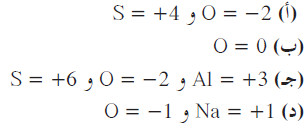
مثال (3): أوجد عدد التأكسد لكل ذرة في ما يلي:
(أ) P2O5
(ب) +NH4
(جـ) Na2Cr2O7
(د) Ca(OH)2
الحل: