معدل التفاعل الكيميائي Rate of Reaction
- هو مقدار التغير في تركيز المواد المتفاعلة أو المواد الناتجة في وحدة الزمن.


- يعبر عنها بوحدة mol/ L.s
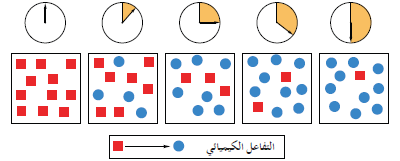
- غالباً ما تقاس سرعات التفاعلات الكيميائية بالتغير فى عدد المولات في خلال فترة زمنية معينة.
- الشكل التالي يوضح تطور تفاعل كيميائي ما
- يمكن تحديد سرعة التفاعل الكيميائي بشكل عملي عن طريق حساب تركيز المواد المتفاعلة أو الناتجة عن التفاعل الكيميائي بينا لا يمكن حساب سرعة التفاعل من المعادلات الموزونة.
- تشير الأقواس التي تكون حول الصيغة الجزيئية للمواد إلى التركيز المولاري فمثلاً [NO2] تمثل التركيز المولاري لـ NO2
- لنفترض أنك ترغب فى التعبير عن متوسط سرعة التفاعل الأتي خلال فترة زمنية بدأت t1 وانتهت عند t2 للمعادلة التالية:
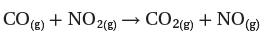
من خلال التفاعل السابق تكون قيمة سرعة تكون المواد الناتجة موجبة ويمكن التعبير عن حساب سرعة تكون NO كما يلي:
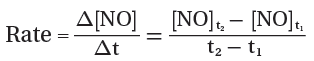
- لنفترض مثلاً أن تركيز NO هو 0.000M عندما تكون t1 = 0 وقد أصبح تركيزه 0.010M بعد ثانيتين من بداية التفاعل فيكون متوسط سرعة التفاعل بوحدة عدد مولات NO الناتجة لكل لتر فى الثانية كالتالي:

العوامل المؤثرة على سرعة التفاعل الكيميائي
(1) درجة الحرارة Temperature
يُؤدّي ارتفاع درجة الحرارة في معظم التفاعلات تقريبًا إلى زيادة في سرعتها.
- حركة الجسيمات المتفاعلة أسرع عند درجات الحرارة الأعلى ، أي أنّ احتمال تصادمها أكبر مقارنة بدرجات الحرارة المنخفضة ما يساعد على تكوين النواتج بسرعة أكبر .
- التأثير الرئيسي لارتفاع درجة الحرارة هو زيادة عدد الجسيمات ذات الطاقة الحركية الكافية لتخطّي حاجز طاقة التنشيط لتتفاعل عند اصطدامها.
(2) التركيز Concentration
- عدد الجسيمات المتفاعلة في حجم معيَّن يُؤثِّر أيضًا في سرعة التفاعلات.
- زيادة عدد الجسيمات في حجم محدَّد يزيد كلًّا من تركيز المتفاعلات وعدد التصادمات ، لذلك تزيد سرعة التفاعل.
(3) حجم الجسيمات Particles Size
- كلّما صغر حجم الجسيمات زادت مساحة السطح لكتلة معينة من الجسيمات (أي مساحة السطح الإجمالي للمادّة المتفاعلة الصلبة أو السائلة) ولذلك تأثير هام في سرعة التفاعل.
- زيادة مساحة السطح تؤدّي إلى زيادة كمّية المادّة المتفاعلة المعرّضة للتفاعل ما يؤدّي بدوره إلى زيادة معدّل التصادمات ، وبالتالي إلى زيادة سرعة التفاعل.
- إحدى طرق زيادة مساحة سطح المتفاعلات الصلبة هي إذابتها حيث تنفصل الجسيمات عن بعضها البعض ، وتزيد إمكانية تفاعلها مع موادّ متفاعلة أخرى . كما يمكن طحن المادّة الصلبة وتحويلها إلى مسحوق ناعم.
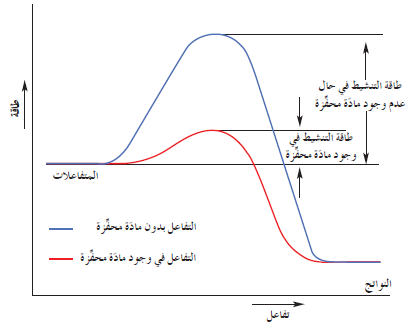
(4) المواد المحفزة Catalysts
- ليست زيادة درجة الحرارة الطريقة الفضلى لزيادة سرعة التفاعل على الدوام فغالبًا ما يكون استخدام مادّة محفِّزة أفضل.
- والمادّة المحفِّزة هي مادّة تزيد سرعة التفاعل من دون استهلاكها ، إذ يمكن بعد توقّف التفاعل استعادتها من المزيج المتفاعل من دون أن تتعرّض لتغيّر كيميائي.
- تساهم الموادّ المحفِّزة في التفاعلات عن طريق إيجاد آلية بديلة ذات طاقة تنشيط أقلّ من الطاقة المطلوبة عادة للتفاعل.
- يُوضِّح الشكل التالي دور الموادّ المحفِّزة في خفض حاجز طاقة التنشيط ، حيث أنّه يكون أكثر انخفاضًا في حالة التفاعل المحفَّز بالمقارنة مع التفاعل غير المحفَّز (يعني ذلك زيادة كمّية النواتج في فترة زمنية معيَّنة).