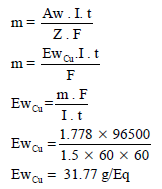قانون فاراداي الأول
إذا تم غمس قطبين في محلول مائي لملح من الأملاح أو حمض أو قاعدة وتم توصيلهما بمصدر تيار نجد حدوث تفاعلات كييمائية على سطح القطب.
- مثال: عند مرور تيار كهربي فى محلول حمض HCl وبإستخدام قطبين من البلاتين نجد تصاعد غاز الكلور عند الآنود وغاز الهيدروجين عند الكاثود وتعتبر هذة التفاعلات أولية ، ويمكن أن تكون مصحوبة بتفاعلات ثانوية. والتفاعلات الأولية تتبع قوانين فارادي للتحليل الكهربي.
- لقد قام مايكل فاراداي عام 1843م بدراسة التحليل الكهربائي وتوصل إلى قانونين يحكمان عملية التحليل الكهربائي.
- فكان فاراداي أول من أكتشف بشكل كمي العلاقة الموجودة بين كمية التيار المستعمل ومدى التغير الكيميائي الذي يحدث عند الأقطاب أثناء التحليل الكهربائي.
نص قانون فارادي الأول
- ينص قانون فاراداى الأول أنه:
" تتناسب كمية المادة (m (g التي يطرأ عليها تغير كيميائي (أكسدة أو اختزال (ذوبان ، ترسيب أو تصاعد غاز)) عند الأقطاب تناسباً طردياً مع كمية الكهرباء (Q) التى تمر في المحلول الإلكتروليتي أو المصهور"
وبإختصار:
" كمية المواد الناتجة بالتحليل الكهربائي تتناسب طردياً مع كمية الكهرباء المارة في المحلول"
- وتقاس كمية الكهرباء (Q) بالكولوم وهو عدد الأمبيرات (شدة التيار) المارة فى وحدة الزمن
الصيغة الرياضية لقانون فارادي الأول
- بافتراض أن كمية المادة التى يطرأ عليها تغير عند الأقطاب (ذوبان / ترسيب / تصاعد غاز) كتلتها (m) بوحدة الجرام (g) ، وشدة التيار المطبقة هي (I) بوحدة الأمبير (A) وزمن مرور التيار هو (t) بوحدة الثانية (s).
فإن القانون الأول بفاراداى بصورته الرياضية:
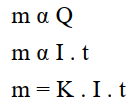
حيث K : ثابت التناسب ويسمى بالمكافئ الكهروكيميائي (electrochemical equivalents) ، وتعتمد قيمته على نوع المادة التى تطرأ عليها تغير.
- ويمكن تعريف المكافئ الكهروكيميائي K رياضياً:
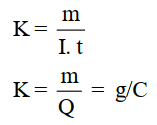
هو كمية المادة (بالجرامات او الكيلو جرامات) التى يطرأ عليها تغير (أكسدة أو أختزال) نتيجة مرور كمية من الكهرباء مقدارها كولوم واحد
حساب المكافئ الكهروكيميائي (K)
- يحسب من العلاقة التالية:
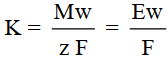
أو من العلاقة التالية:
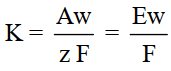
حيث أن:
MW : تعبر عن الوزن الجزيئي عندما يكون الناتج جزيئاً مثل (H2 , Cl2).
AW : تعبر عن الوزن الذري عندما يكون الناتج معدناُ مثل (Ag , Cu)
EW : يعبر عن الوزن المكافئ وهو عبارة عن قسمة الوزن الجزيئي أو الوزن الذري على عدد الإلكترونات المتنقلة فى التفاعل الموزون (z)
وعلى هذا يمكن تعريف المكافئ الكهروكيميائي (K) بأنه:
"وزن العنصر المترسب بمرور واحد كولوم من الكهرباء"
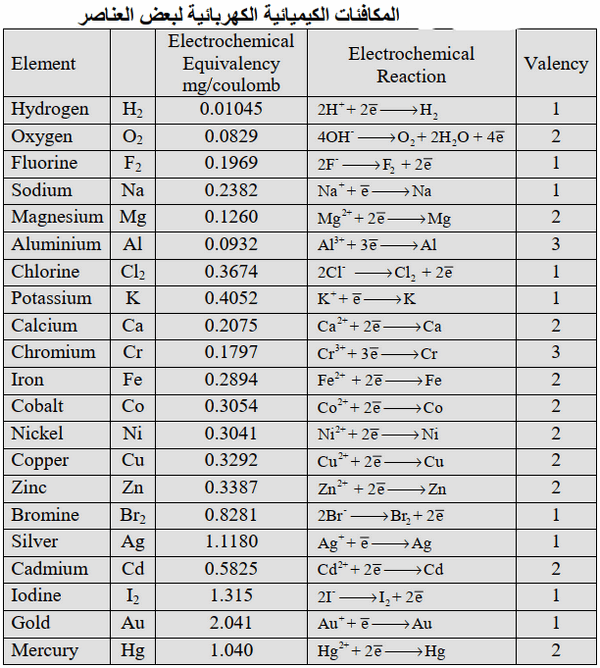
- الجدول التالي يوضح بعض المكافئات الكيميائية الكهربائية لبعض العناصر المعروفة:
- بدمج العلاقتين (K = Aw / ZF) والعلاقة (m = K . I . t) في قانون واحد:
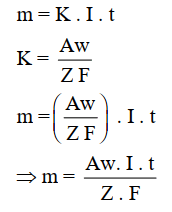
وبما أن Q = I .t فأن:
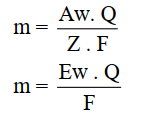
حيث Ew = Aw / Z
مثال (1) : احسب الوزن المكافئ الكهروكيميائي لكل من الهيدروجين (H2) والفضة (Ag) إذا علمت أن الكتل الذرية (Ag = 108 , H = 1)
الحل :
باستخدام قانون المكافئ الكهروكيميائي التالي:
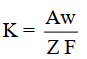
يكون:
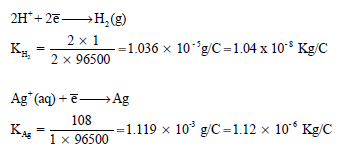
مثال (2): مرر تيار شدته (1.5A) فى محلول CuCl2 ولمدة ساعة. فإذا كان وزن النحاس المترسب (1.778) فما الوزن المكافئ للنحاس؟
بتطبيق قانون فارادي الأول