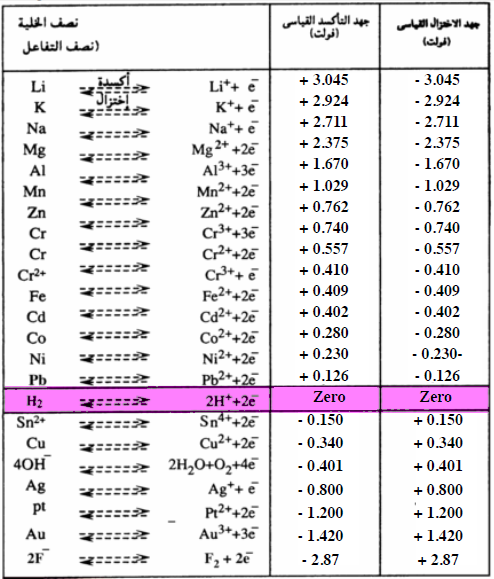
السلسلة الكهروكيميائية Electrochemical series
- تعرف أيضاً بسلسلة الجهود الكهربية للعناصر The electromotive series
- وتعرف أيضاً بسلسلة جهود الأختزال القياسية Standard Reduction Potential Series
- تمكن العلماء من قياس الجهود القطبية القياسية (Eo) لأنصاف الخلايا لجميع العناصر الفلزية واللافلزية مقاسة بالنسبة لجهد قطب الهيدروجين القياسي.
- السلسلة الكهروكيميائية هي ترتيب الجهود القياسية ترتيباً تنازلياً بالنسبة لجهود الاختزال السالبة وتصاعدياً بالنسبة لجهود الأختزال الموجبة بحيث يكون أكبر القيم السالبة في أعلى السلسلة وأكبر القيم الموجبة فى أسفلها.
ملاحظات هامة على السلسة الكهروكيميائية
توضح سلسلة الجهود الكهربية للعناصر الحقائق التالية:
(1) العناصر ذات الجهود الأكثر سالبية والتى تقع عند قمة السلسلة تعتبر عوامل مختزلة قوية - وهي الفلزات التى تتأكسد بسهولة أى أنها تفقد إلكتروناتها بسهولة عندما تدخل في تفاعل مع أيونات أى عنصر يحتل مكانة أدنى في سلسلة الجهود الكهربية.
(2) العناصر ذات الجهود الأكثر إيجابية والتى تقع عند النهاية السفلى للسلسلة تعتبر الصورة المتأكسدة لها (أى عندما تكون الفلزات على هيئة أيونات وتكون اللافلزات في حالتها العنصرية) عوامل مؤكسدة قوية مثل جزيئات غاز الفلور (F2). بمعنى أنها ذات قدرة أكبر على إكتساب الالكترونات عندما تدخل في تفاعل مع أى عنصر يحتل مكانه أعلى في سلسلة الجهود الكهربية.
(3) العناصر المتقدمة فى السلسلة حل محل العناصر التى تليها في محاليل أملاحها - وكلما زاد البعد فى الترتيب بين عنصرين زادت قدرة العنصر المتقدم (ذو الجهد الأكثر سالبية أو الأقل إيجابية) على طرد العنصر المتأخر (ذو الجهد الأقل سالبية أو الأكثر إيجابية) من مركباته.
(4) جميع العناصر التى تقع فوق الهيدروجين في سلسلة الجهود الكهربية تحل محل أيونات الهيدروجين في المحاليل الحمضية (أى يتصاعد الهيدروجين)
مثال ذلك تفاعل عنصر الحديد مع حمض الهيدروكلوريك.
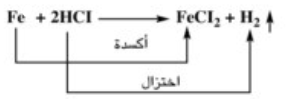
كلما زادات القيمة السالبة للجهد زاد الميل نحو الإحلال محل أيونات الهيدروجين.
أما العناصر ذات الجهود الموجبة أى التى تقع تحت الهيدروجين في سلسلة الجهود الكهربية فلا يمكن لها أن تحل محل أيونات الهيدروجين فى محاليله.
(5) فى السلسلة الكهروكيميائية يتم ترتيب العناصر في سلسلة الجهود الكهربية تبعاً لجهود الأكسدة القياسية تنازلياً بالنسبة للجهود الموجبة وتصاعدياً بالنسبة للجهود السالبة.
(6) كلما نقصت جھود الإختزال القیاسیة للأقطاب كلما كانت قابلیة المادة للأكسدة أعلى من قابلیتھا للإختزال (تزداد قدرتھا كعوامل اختزال). ومن جدول السلسلة الكھروكیمیائیة فإن أقوى العوامل المختزلة (أسھل العناصر أكسدة) ھو اللیثیوم (Li)
كلما قلت قیمة جھد الإختزال كلما زادت قوة المادة كعامل مختزل
(7) كلما زادت قیم جھود الإختزال للأقطاب كلما كانت قابلیة المادة للإختزال أعلى من قابلیتھا للأكسدة (تزداد قدرتھا كعوامل أكسدة). وأقوى العوامل المؤكسدة (أسھل العناصر اختزالاً) ھو الفلور F2
كلما زاد قیمة جھد الإختزال كلما زادت قوة المادة كعامل مؤكسد
(8) في أي نظام (خلیة كھروكیمیائیة) یحتوي على قطبین، فإن القطب ذو جھد الإختزال الأكبر یمثل المھبط، ویمثل الى جھة الیمین في ھندسة الخلیة، بینما القطب ذو جھد الإختزال الأصغر فیمثل المصعد، ویمثل الى الجھة الیسار.
(9) یحدد القطب الذي یحدث له أكسدة والذي یحدث له اختزال من خلال قیم جھود الإختزال وفقاً للعلاقة التالیة:
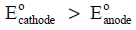
- وفيما يلي سلسلة الجهود الكهروكيميائية للعناصر: