طومسون وكتلة وشحنة الألكترون
- رغم النجاح الذي تحقَّق من تجارب بأشعة المهبط الإ أن أحداً لم يستطع تحديد كتلة جسيم واحد من جسيمات أشعة المهبط.
- لذا بدأ العالم طومسون سلسلة من التجارب على أشعة المهبط في جامعة كمبردج في أواخر القرن التاسع عشر؛ لتحديد نسبة شحنتها إلى كتلتها.
- استطاع العالم طومسون تحديد نسبة شحنة جسيمات أشعة المهبط إلى كتلتها، عندما قاس تأثير كل من المجال المغناطيسي والكهربائي في هذه الأشعة، ثم قارن هذه النسبة بنسب أخرى معروفة.
- استنتج طومسون ان كتلة الجسيم المشحون أقل كثيراً من كتلة ذرة الهيدروجين، وهي أصغر ذرة معروفة. وهذا الاستنتاج كان مفاجئاً لأنة يعنى أن هذة الجسميات أصغر من الذرة ، لذا فإن جون دالتون كان مخطئاً إذ يمكن تجزئة الذرات إلى جسيمات أصغر.
- ورغم أن نظرية دالتون الذرية كانت مقبولة بشكل واسع الإ أن أستنتاجات طومسون كانت حاسمة ، وإن وجد كثير من العلماء صعوبة فى قبولها.
- لكن طومسون كان على صواب فقد استطاع اكتشاف أول جسيم من الجسيمات المكونة للذرة وهو الألكترون.
- حصل طومسون على جائزة نوبل عام 1906م عن هذا الاكتشاف.
- لكن العالم روبرت مليكان عام 1910 قام بتحديد شحنة الألكترون مستعملاً جهازة قطرت الزيت.
تجربة طومسون لتعيين النسبة (e/m) للإلكترون
- استطاع طومسون عام 1897م أن يعين القيمة العددية لنسبة شحنة الإلكترون إلى كتلته e/m بواسطة استخدام انحراف مسار شعاع أشعة المهبط في أنبوبة محاطة بمجالين أحدهما مغناطيسي والآخر كهربي متعامدين على بعضهما .
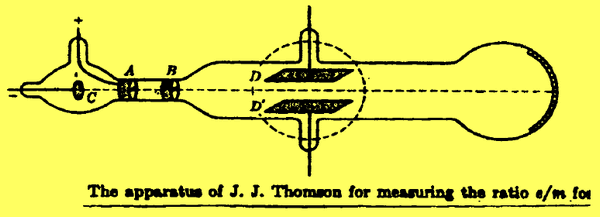
- إذا تحرك تيار من دقائق سالبة الشحنة ( أشعة المهبط) (C) وكانت شحنة الالكترون ( الجسيم (e) وكتلته (m) وله سرعة (ν) في اتجاه خط مستقيم متعامد عليها مجال مغناطيسي شدته (H) وهذه القوة المؤثرة مقدارها Hev . فأن الجسيمات تصبح في مسار دائري نصف قطره (r) حيث هذه القوة المغناطيسية تساوي القوة الطاردة المركزية علي الإلكترون بناءاً على التجاذب الحادث للمجال الكهربي الموجب (A) - الأنود
Heν = mν2/r
e/m = ν/Hr
- ويمكن قياس انحناء (r) مسار أشعة المهبط عندما تحيد في مجال شدته (H) ، ولكن أيضا يلزم معرفة السرعة (ν) حتى يمكن تعيين (e/m).
- لذلك يستخدم مجال كهربي شدته (X) متعامد على المجال المغناطيسي ويؤثر على الشحنة بقوة (Xe) ويضبط بحيث تعيد الإلكترون إلى مساره الأصلي وهو الخط المستقيم ، وعندما تساوي المجالين يكون :
Xe = Heν
ν = X/H
وبالتعويض في المعادلة أعلاه نجد أن :
e/m = X/H2r
ومن قيم كل من X ، H يمكننا حساب النسبة (e/m) وهي قيمة ثابتة مهما كان نوع الغاز وتساوي 108 × 1.759 كولوم علماً بأن سرعتها ليست عالية.