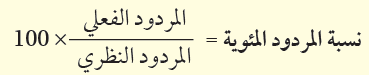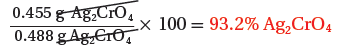مقدار المادة الناتجة من التفاعل
- كما أنه ليس من المحتمل أن تدخل كرة السلة الهدف 100 مرة من خلال 100 رمية خلال التدريب، كذلك لا تنتج معظم التفاعلات كمية الناتج المتوقعة.
- ولأسباب متعددة تتوقف التفاعلات قبل الاكتمال، ولا تنتج كميات النواتج المتوقعة منها ومن هذة الأسباب:
(1) قد تلتصق المواد المتفاعلة والناتجة- في الحالة السائلة -على سطوح الأوعية أو تتبخر.
(2) قد تنتج مواد أخرى غير متوقعة بسبب تفاعلات التنافس التي تقلل من كمية الناتج المرغوب فيه .
(3) قد تترك بعض كميات المواد الصلبة جانباً على ورقة الترشيح أو تفقد بسبب عملية التنقية كما بالشكل التالي:

تتشكل كرومات الفضة عند إضافة كرومات البوتاسيوم إلى نترات الفضة. لاحظ أن بعضاُ من المادة المترسبة قد ترك جانباً على ورقة الترشيح ، كما أن كمية أخري منها تفقد لأنها قد تعلق على جوانب الإناء.
ونتيجة هذة المشاكل فإن الكيميائيين بحاجة إلى معرفة كيفية تحديد كمية الناتج في التفاعل الكيميائي.
المردود النظري والمردود الفعلي
في كثير من الحسابات قمت بحساب كمية الناتج من كمية مادة متفاعلة معطاة. وتسمى كمية الناتج المحسوبة هذة المردود النظري للتفاعل.
- المردود النظري هو أكبر كمية من الناتج يمكن الحصول عليها من كميات معينة من المواد المتفاعلة ويحسب بالأعتماد على المعادلة الكيميائية الموزونة..
- نادراً ما ينتج عن التفاعل الكيميائي مردود فعلى مطابق للمردود النظري المتوقع. يحدد الكيميائي المردود الفعلي للتفاعل من خلال تجربة دقيقة يحسب من خلالها كتلة المادة الناتجة .
- المردود الفعلي هو كمية المادة الناتجة عند إجراء التفاعل الكيميائي التي يتم الحصول عليها عملياً من التفاعل.
نسبة المردود المئوية Percent Yield
- يحتاج الكيميائيون إلى معرفة فاعلية التفاعل في إنتاج النواتج المرغوب فيها.
- ومن طرائق قياس فاعلية التفاعل حساب نسبة المردود المئوية
- نسبة المردود المئوية للنواتج هي نسبة المردود الفعلي إلى المردود النظري معبرًا عنها بالنسبة المئوية.

- إن نسبة المردود المئوية المرتفعة مهمةٌ في تقليل تكلفة كل مادة ناتجة عن العمليات الكيميائية.
مثال لحساب نسبة المردود المئوية
تتكون كرومات الفضة الصلبة Ag2CrO4 عند إضافة كرومات البوتاسيوم K2CrO4 إلى محلول يحتوى على 5g من نترات الفضة AgNO3.
(1) احسب المردود النظري لكرومات الفضة Ag2CrO4
(2) احسب نسبة المردود المئوية إذا كانت كتلة كرومات الفضة Ag2CrO4 الناتجة فعلياً عن التفاعل هي 0.455g
تحليل المسألة
- كتلة المواد المتفاعلة وكتلة المردود الفعلي معلومة من المعطيات.
- احسب المردود النظري بتحويل جرامات AgNO3 إلى مولات AgNO3 ، ومن ثم تحويل AgNO3 إلى مولات Ag2CrO4 ، وأخيراً تحويل مولات Ag2CrO4 إلى جرامات Ag2CrO4.
- ثم نحسب قيمة نسبة المردود المئوية بقسمة المردود الفعلى إلى المردود النظري والضرب فى 100
المعطيات والمطلوب
كتلة نترات الفضة = 0.5g AgNO3 ، المردود الفعلي = 0.455g AgCrO4
المردود النظري = ?? Ag2CrO4 ، المردود المئوي = ?? Ag2CrO4
حساب المطلوب
أولاُ: حساب المردود النظري
(1) نكتب المعادلة الموزونة ونحدد المعطيات والمطلوب
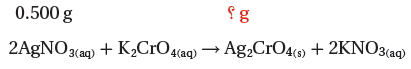
(2) استخدم الكتلة المولية لتحويل جرامات AgNO3 إلي عدد مولات AgNO3
(الكتلة المولية لنترات الفضة) 1mol → 169.9g
(الكتلة المستخدمة فى التفاعل) mol → 0.5g ??
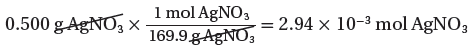
(3) استخدم النسبة المولية لتحويل عدد مولات AgNO3 إلي عدد مولات Ag2CrO4
من المعادلة الموزونة نجد أن:
2mol AgNO3 → 1mol Ag2CrO4
2.94x10-3mol AgNO3 → ?? mol Ag2CrO4
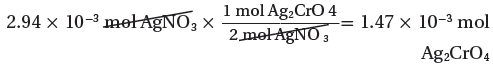
(4) نحسب كتلة المردود النظري للمركب Ag2CrO4
(الكتلة المولية لللمركب) 1mol → 331.7g
(الكتلة الناتجة من التفاعل) 1.47x10-3mol → ?? g
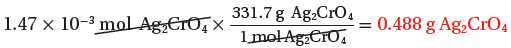
ثانياً: نسبة المردود المئوية