الألكترون Electron
- اكتشف طومسون Thomson الألكترون وقام بتحديد النسبة بين شحنة الألكترون إلى كتلته e/m
- استطاع مليكان تحديد شحنة الألكترون ومقدارها (-1) وكتلته = 1/1840 من كتلة ذرة الهيدروجين.
- عدد الألكترونات التى تدور حول النواة = عدد البروتونات الموجبة الموجودة بالنواة لذلك فالذرة متعادلة كهربياً.
- تحاط النواة بسحابة من الإلكترونات وهى سريعة الحركة.
- ترتيط الألكترونات مع الذرة من خلال التجاذب مع الشحنات الموجبة الموجودة في النواة
- العدد الذري لأى عنصر = عدد الإلكترونات
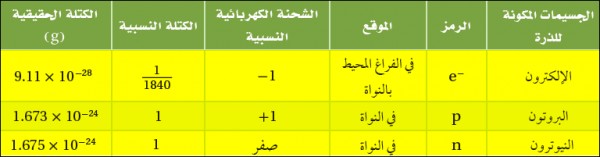
البروتون Proton
- في عام 1920 قام رذرفورد بشرح مفهوم النواة واستنتج أن النواة تحتوى على جسيمات تسمى البروتونات.
- البروتون يرمز له بالرمز (P)
- البروتون جسيم ذري يحمل شحنة تساوي شحنة الإلكترون.
- شحنة البروتون هي (+1)
- يتكون البروتونات من ارتباط 2 كوارك Quark علوي (u) وواحد كوارك سفلي (d)
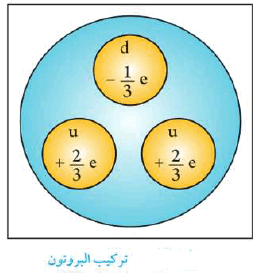
النيوترون Neutron
- في عام 1932 م بيَّن العالم جيمس شادويك James Chadwick أن النواة تحتوي أيضاً على جسيمات متعادلة سميت النيوترونات.
- النيترون جسيم ذري كتلته قريبة من كتلة البروتون، ولكنه لا يحمل شحنة كهربائية ويرمز له بالرمز (n)
- وفي عام 1935 م حصل شادويك على جائزة نوبل في الفيزياء؛ لإثباته وجود النيوترون.
- يتكون البروتونات من ارتباط واحد كوارك Quark علوي (u) و 2 كوارك سفلي (d)
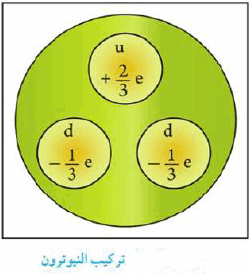
خصائص البروتونات والنيترونات والإلكترونات