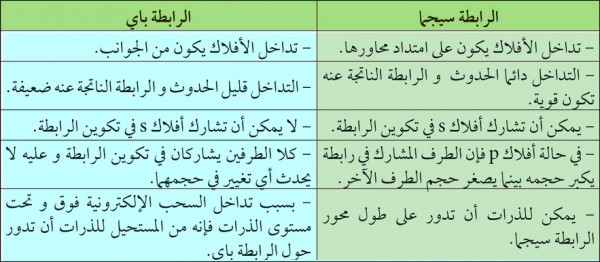
الرابطة سيجما σ) Sigma bond)
- هي رابطة تنشأ من التداخل الأفقي للأفلاك (الرأس بالرأس) أى أن الأوربتالان المتداخلان يكونان على خط واحد.
- مثال ذلك تداخل الأوربتال المهجن (sp2) في ذرة الكربون مع الأوربتال (1s) لذرة الهيدروجين.
- كذلك تداخل الأوربتال المهجن (sp2) لذرة كربون بالرأس معاُ لأوربتال (sp2) لذرة الكربون الأخري في جزئ الإيثيلين.
- أمثلة أخري : تداخل (1s) مع (1s) ، تداخل (1s) مع (px) ، تداخل (px) مع (px)
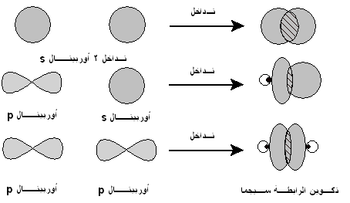
الرابطة باي π) Pi bond)
- هي رابطة تنشأ من التداخل الجانبي للأفلاك الذرية غير المهجنة أي أن الأوربتالان المتداخلان متوازيان.
- أمثلة : تداخل الأوربتال (pz) لذرة كربون بالجنب مع الأوربتال (pz) لذرة كربون أخرى كما فى جزئ الإيثيلين.
- درجة تداخل الأفلاك الإلكترونية في رابطة سيجما (σ) أعلى من درجة التداخل في الرابطة باي (π) لهذا فأن الرابطة سيجما (σ) أقوى من الرابطة باي (π).
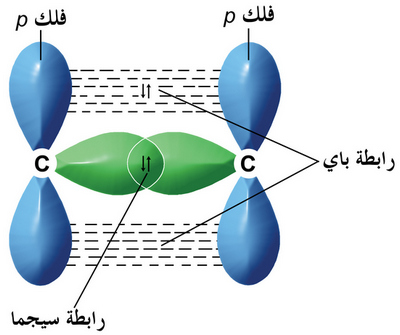
- الرابطة باى أطول وأضعف من الرابطة سيجما لأن التداخل بالرأس يكون أقوى من التداخل الجانبي
مقارنة بين الرابطة سيجما والرابطة باي