القاعدة الثمانية Octet rule
- عندما تخسر ذرة الصوديوم إلكترون التكافؤ الوحيد لديها لتنتج أيون صوديوم +1 يتغير التوزيع الألكتروني على النحو الآتي:
Na11: 1s2 2s2 2p6 3s1
Na+: 1s2 2s2 2p6
- لاحظ أن التوزيع الألكتروني لأيون +Na مشابة للتوزيع الألكتروني للنيون (غاز نبيل).
- تنص القاعدة الثمانية على أن:
" أن الذرة تكتسب الإلكترونات أو تخسرها أو تشارك بها، لتحصل على ثمانية إلكترونات تكافؤ في مستواها الأخير".
- يجب أن تلاحظ أن هذه القاعدة لا تشمل عناصرالدورة الأولى؛ لأنها تحتاج إلى إلكترونين فقط.
أهمية قاعدة الثمانية
- تكمن فائدة هذة القاعدة في تحديد نوع الأيون الذي ينتجه العنصر.
- العناصر التي على الجانب الأيمن من الجدول الدوري تكسب عادة الألكترونات لتحصل على التوزيع الألكتروني للغاز النبيل. ولهذا السبب تنتج هذة العناصر أيونات سالبة.
- إلا أنه بطريقة مشابهة - تفقد العناصر التي على الجانب الأيسر الإلكترونات لتنتج أيونات موجبة.
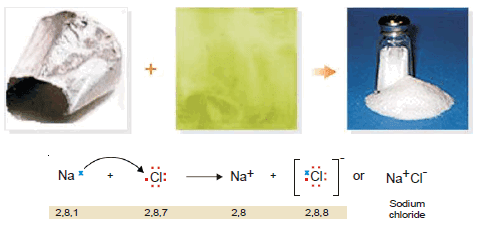
- ففي مركب كلوريد الصوديوم يفقد الصوديوم الكتروناً للوصول إلى أقرب غاز خامل وهو النيون Ne10 ويكتسب الكلور هذا الألكترون ليصل إلى التركيب الألكترونى لغاز الأرجون Ar18 وتتكون رابطة آيونية بين الصوديوم والكلور مكونة مركب كلوريد الصوديوم.