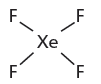
رسم تركيب لويس لجزئ XeF4
- لمراجعة خطوات رسم تركيب لويس لأى جزئ يمكن الرجوع إلى هذا الرابط: قواعد رسم تراكيب لويس
- الزينون غاز نبيل يكون مركبات نادرة عند تفاعله مع اللافلزات الشديدة الجذب للألكترونات.
(1) فى الجزئ XeF4 الذي يحتوى على ذرة (Xe) واحدة ، وأربع ذرات (F) ولأن جاذبية Xe للألكترونات قليلة لذلك يكون هو الذرة المركزية.
(2) نوجد العدد الكلي لإلكترونات التكافؤ.
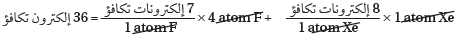
(3) حدد العدد الكلي لأزواج الربط.
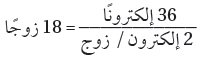
(4) استخدم أزواج الربط الأربعة لربط أربع ذرات (F) مع ذرة (Xe) المركزية.
(5) حدد عدد الأزواج غير الرابطة.
18 زوجاً (المجموع الكلي) – 4 أزواج مستخدمة = 14 زوجاً غير رابط
(6) أضف ثلاثة أزواج إلكترونات إلى كل ذرة (F) . وأوجد عدد الأزواج غير الرابطة.
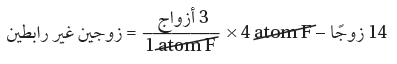
(7) ضع الزوجين المتبقين على ذرة (Xe) المركزية.

يعطى هذا التركيب ذرة الزينون 12 إلكتروناُ وهذا يعنى أنها تصل إلى حالة الأستقرار بأكثر من 8 إلكترونات .
- تعد مركبات الزينون ومنها XeF4 سامة بسبب قدرتها العالية على التفاعل.