السالبية الكهربية
- هي مقياس لمقدرة الذرة أو الجزيء على جذب الإلكترونات في الروابط الكيميائية .
- تعتمد نوعية الرابطة المتكونة اعتمادا كبيرا على الفرق في السالبية الكهربية بين الذرات الداخلة فيها .
- تقوم الذرات المتشابهة في السالبية الكهربية "بسرقة" الإلكترونات من بعضها البعض والذى يرجع لما يسمى " مشاركة " وتكون رابطة تساهمية . ولكن لو كان هذا الفرق كبير سينتقل الإلكترون إلى أحد الذرات وتتكون رابطة أيونية . إضافة إلى ذلك في حالة أن أحد الذرات تقوم بسحب الإلكترونات بقوة أكبر قليلا من الأخرى فإنه تتكون رابطة تساهمية قطبية .
قياس السالبية الكهربية
يتم قياس السالبية الكهربية بطرق عديدة ولكن سوف نتطرق هنا إلى ثلاث مقاييس :
(1) مقياس باولنج Pauling Electronegativity
- قام العالم لينوس بولينغ بوضع مقياس رقمي لقيم السالبية الكهربائية.
- لكل عنصر كيميائي سالبية كهربية مميزة تتراوح بين (صفر - 4)
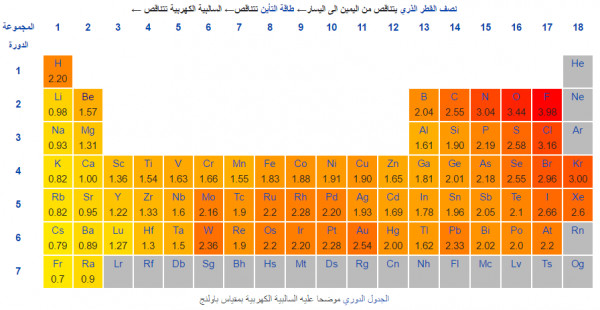
- يكون عنصر الفلور هو أعلى العناصر في السالبية الكهربية حيث تبلغ 3.98 ، بينما أقل العناصر سالبية كهربية هو الفرنسيوم وله قيمة تبلغ 0.7 ، والعناصر الباقية تتراوح قيمها بين هاتين القيمتين
- يتم حساب الفرق في السالبية الكهربية بين العنصرين A ، B من العلاقة :
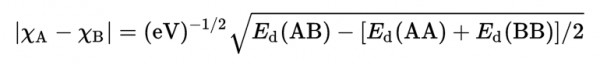
Ed = طاقة التفكك = dissociation energy
xA = السالبية الكهربية للعنصر A
xB = السالبية الكهربية للعنصر B
والصورة توضح السالبية الكهربية لعناصر الجدول الدوري مقاسة بمقياس باولينج
(2) مقياس مولكين Mulliken Electronegativity
- يتم حساب الأرقام في مقياس مولكين بعمل متوسط لجهد التأين والألفة الإلكترونية.
- على هذا يتم التعبير عن السالبية الكهربية مباشرة بوحدات الطاقة ، وعادة ما تكون بالإلكترون فولت ويعبر عنها بالعلاقة :

Ei = طاقة التأين = ionization energy
Eea = الميل الألكتروني = electron affinity
(3) مقياس Allred-Rochow Electronegativity
وفى هذا المقياس يتم حساب السالبية الكهربية من العلاقة الآتية :
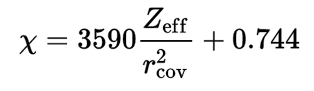
zeff = شحنة النواة الفعالة = effective nuclear charge
rcov = نصف القطر التساهمي = covalent radius