المادة المحددة للتفاعل
- بنيت الحسابات التى أجريتها في الأمثلة السابقة على وجود المواد المتفاعلة بالنسبة التى تحددها معادلة التفاعل الموزونة. وعندما لا تكون الحالة على هذا النحو فإن عليك معرفة المادة المحددة للتفاعل أولاً.
- فى التفاعل التالي:

- نجد أن التفاعل السابق يصف تفاعل ثلاثة جزيئات من النيتروجين N2 مع ثلاثة جزيئات من الهيدروجين H2 لتكوين غاز الأمونيا NH3 ، إذ تتحلل جزيئات النيتروجين والهيدروجين في بداية التفاعل إلى ذرات منفصلة تتفاعل معًا لتكوين جزيئات الأمونيا.
- ما عدد جزيئات الأمونيا المتكوّنة؟ يمكن تكوين جزيئين من الأمونيا، وذلك بسبب وجود ستة ذرات هيدروجين، ترتبط كل ثلاث منها مع ذرة النيتروجين. لذا يعد الهيدروجين مادة محدة للتفاعل ، في حين يعد النيتروجين مادة فائضة.
- لذا من الضروري معرفة المادة المحددة للتفاعل والمادة الفائضة ، لأن كمية المادة الناتجة تعتمد على ذلك.
حساب المادة المحددة للتفاعل
- لنأخذ مثالاً على ذلك مركب ثنائي كلوريد ثنائي الكبريت الذي يستخدم في صناعة جلفنة المطاط .
- حيث يحضر هذا المركب بتفاعل مصهور الكبريت مع غاز الكلور حسب المعادلة:
(S8(l) + 4Cl2(g) → 4S2Cl2(l
- ما مقدار ثنائي كلوريد ثنائي الكبريت S2Cl2 الناتج عن تفاعل 200g من مصهور الكبريت مع 100g من غاز الكلور؟
- لقد أعطيت كتلتي المادتين المتفاعلتين، لذا عليك أن تحدد أولاً أيهما المادة المحددة للتفاعل؛ لأن التفاعل سيتوقف عندما تستهلك هذه المادة تمامًا.
إيجاد مولات المواد المتفاعلة
- يتطلب تعرّف المادة المحددة للتفاعل إيجاد عدد مولات كل مادة متفاعلة.
- وذلك بتحويل كتل المواد إلى مولات.
- يمكنك تحويل كتلة كل من الكلور والكبريت إلى مولات، بضرب كتلة كل مادة في عامل تحويل يساوي معكوس الكتلة المولية لكل منها.
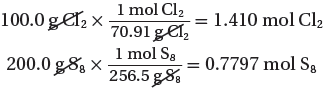
استعمال نسب المولات
- تتطلب الخطوة الآتية معرفة النسبة المولية الصحيحة التى تربط بين المادتين كما أعطيت فى المعادلة الموزونة.
- تبني معاملات المعادلة الموزونة وجود (4) مولات من Cl2 لكل مول واحد من S8 أى أن النسبة بينهما (4:1) ويتطلب تحديد النسب الصحيحة المقارنة بين النسبة (4:1) ونسب المولات الفعلية للمواد الناتجة.
- ولإجراء ذلك نقسم عدد مولات الكلور الفعلية على مولات الكبريت الفعلية أيضاً.
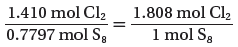
- تظهر الحسابات أن النسبة هي 1.808mol من Cl2 لكل 1mol من S8 بدلاً من 4mol من Cl2 كما تظهر المعادلة. ولذلك يكون الكلور هو المادة المحددة للتفاعل.