الكبريتات -SO42
- هو أيون متعدد الذرات يتكون من ذرة واحدة أكسجين وأربع ذرات أكسجين ويتصرف في معظم التفاعلات كذرة واحدة.
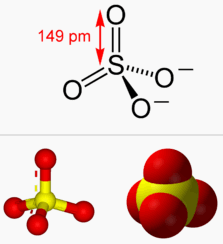
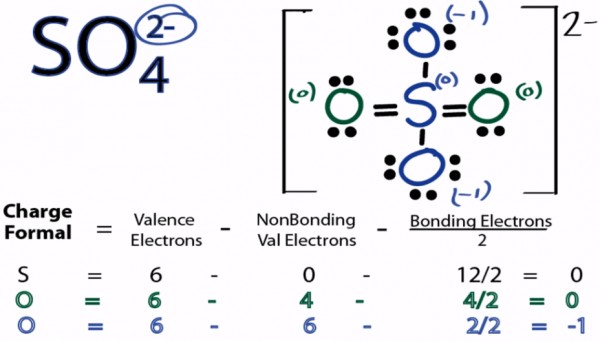
- مجموعة أيونية تحمل الصيغة SO4 ، وشحنتها (-2) . والشحنة الثنائية السالبة (-2) التي تحملها مجموعة الكبريتات الأيونية تعني أن مجموع شحنة أيون الكبريت ، وأيونات الأكسجين الأربع تساوي (-2).
شحنة الكبريت = +6 × 1 ( عدد الذرات ) = +6
شحنة الأكسجين = -2 × 4 ( عدد الذرات ) = -8
المجموع = شحنة أيون الكبريتات = -2
- تشغل الكبريت فى الكبريتات مركزاً رباعي الوجوة Tetrahedral كما فى جزئ جمض الكبريتيك.

- يوجد (6) اشكال رنين لأيون الكبريتات
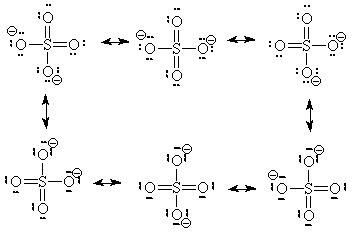
الترابط فى أيون الكبريتات
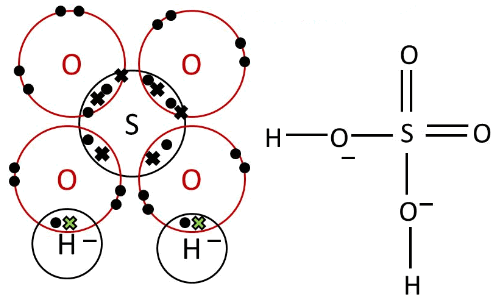
- يتكون أيون الكبريتات من أربع ذرات أكسجين وذرة مركزية واحدة وهي الكبريت.
- تتكون رابطتين S=O ورابطتين -S-O ويكون شكل رباعي الأوجه Tetrahedral
- السالبية الكهربية للكبريت = 2.5 ، السالبية الكهربية للأكسجين = 3.5
- الفرق فى السالبية بين الكبريت والأكسجين = 1 ، لذلك تتكون روابط تساهمية قطبية.
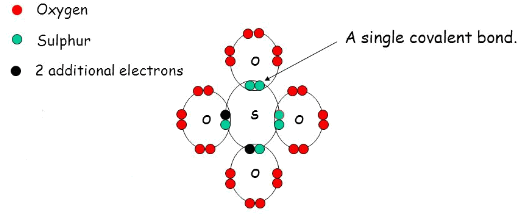
ففى حمض الكبريتيك نجد أن الرابط يتم على الصورة التالية:
اشحنة التقديرية فى ايون الكبريتات
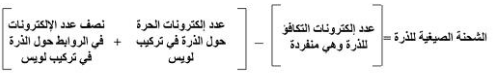
مثال للتوضيح
أيون الكبريتات له تركيب لويس تكون فيه جميع الروابط أحادية، وعدة تراكيب تحتوي على روابط ثنائية.المطلوب حساب الشحنة الصيغية Formal charge على كل ذرة في الصيغتين التاليتين ، ثم حدد التركيب الأكثر ثباتا منهما.
ملاحظة:
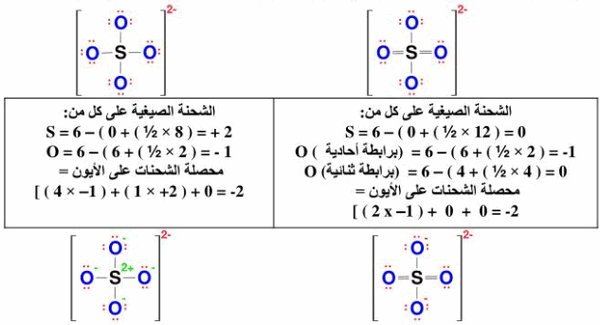
ولاختيار أنسب تركيب يمكن أن يصف الروابط سوف نجد أن التركيب الذي يحتوي على روابط ثنائية، هو التركيب الأحسن لأن الشحنة الصيغية (The formal charge) على كل من ذرة الكبريت وذرتي الأكسجين المرتبطتين بروابط ثنائية تساوي صفر، وتوجد الشحنة السالبة علي ذرتي الأكسجين المرتبطتين بروابط أحادية، وهي الذرة الأعلى سالبية ، وهذه الشروط تتفق والشروط السابقة الخاصة بتحديد التركيب المفضل أي الأكثر ثباتا.
التركيب الهندسي لأيون الكبريتات