كثافة الغاز Density of gas
أولاً: حساب كثافة الغاز عن الظروف القياسية STP
- يمكن تعريف الكثافة بالعلاقة التالية:

- وحدات الكثافة للمواد الصلبة والسائلة : g/cm3 أو g/mL أو Kg/m3
- أما وحدات الكثافة بالنسبة للغازات فان كتلة 1 مليلتر تكون صغيرة جداً يصعب التعامل بها عملياً، فلذلك قد أتخذ
اللتر (L) كوحدة حجم لقياس كثافة الغاز.
- أن حجوم الغازات تتأثر تأثراً كبيراً بالضغط ودرجة الحرارة، فعليه يجب ان تحدد الظروف التي تقاس بها كثافة الغازات
- تدعى الظروف التي يقاس عندها الغاز في درجة حرارة صفر درجة سيليزية (0°C) وضغط 1 جو (1atm) بالظروف القياسية. (Standard Temparatuer and Pressure (STP
مثال (1): اذا علمت ان كثافة غاز ما تساوي 0.7g/L ويشغل حجماً مقداره 490cm3 عند STP ماهي كتلة هذا الغاز ؟
- نحول وحدة الحجم cm3 الى وحدة (L):
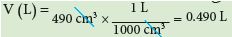
- ولحساب كتلة الغاز نستخدم العلاقة:
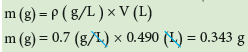
ثانياً: حساب كثافة الغاز عن ضغط ودرجة حرارة معينة
- يتم حساب الكثافة عند ضغط ودرجة حرارة معينة عن طريق هذا القانون:
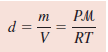
حيث: d = الكثافة ، P = الضغط ، R = الثابت العام للغازات ، µ = الكتلة المولية ، T = درجة الحرارة بالكلفن
- ويمكن استنتاج القانون السابق كالتالي:

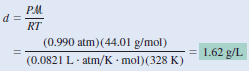
مثال (2): احسب كثافة ثانى أكسيد الكربون CO2 بوحدة g/L عند ضغط 0.99atm ودرجة حرارة 55Co؟
- الكتلة المولية لـ CO2 =
(16 × 2) + 12 = 44g/mol
-تحويل درجة الحرارة من سلزيوس إلى كلفن:
T = 273 + 55 = 328 K
نعوض فى القانون السابق: