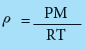ماهي كثافة غاز الامونيا عند 30 درجة مئوية وضغط 2.5atm ؟
الحل:

M = الكتلة المولية للأمونيا NH3 =
= (1 × 14) + (3 × 1)= 17g/mol
P = الضغط = 2.5atm
T = درجة حرارة = 30 + 273 = 303 كلفن
R = الثابت العام للغازات = 0.082L.atm/mol.K
وبالتعويض فى القانون التالي نحصل على الكثاف بوحدة g/L:
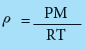
0.082 * 303 / 2.5 * 17 =
0.082 * 303 / 2.5 * 17 =
1.71g/L =
كيفية استنتاج القانون المستخدم لحساب كثافة الغاز
- من القانون العام للغازات المثالية فأن:
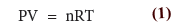
- وبما أن المول (n) يعرف بأنه :
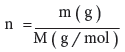
- نعوض عن (n) بالمعادلة (1) لنحصل على:
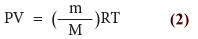
ويمكن كتابتها على الصورة:
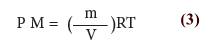
- ومن تعريف الكثافة (ρ):
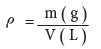
- نعوض عن الكثافة بالمعادلة (3) نحصل على:
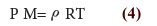
- وبترتيب المعادلة (4) نحصل على المعادلة التالية التي تمثل علاقة رياضية لحساب كثافة الغاز من معرفة الضغط والكتلة المولية عند درجة حرارة معينة .