قانون دالتون للضغوط الجزيئية Dalton’s law of partial pressures
- هذا القانون مختص فى حالة وجود خليط من الغازات التي لا تتفاعل مع بعضها البعض كالهواء مثلاً.
- لقد قام دالتون بدراسة الهواء ولاحظ أن الضغط الكلي للغازات يساوي مجموع الضغوط الجزئية لكل غاز على حدة كما لو كان هذا الغاز موجوداً لوحده في الوعاء. وأن ضغط كل غاز على حدة يسمى بالضغط الجزئي
- وينص قانون دالتون :
إن الضغط الكلي لخليط من الغازات يساوي مجموع الضغوط الجزئية لكل غاز في الخليط على شرط ان لا يحدث تفاعل بينها
التعبير الرياضي لقانون دالتون
- ويمكن التعبير رياضياً عن قانون دالتون كالتالي:
....... + PT = P1 + P2 + P3
حيث PT تمثل الضغط الكلي و P1 و P2 و P3 ...... الخ تمثل الضغوط الجزئية للغازات المكونة للخليط.

- يعتمد الضغط الجزئي للغاز على عدد مولاته، وحجم الوعاء، ودرجة حرارة خليط الغازات، ولكنه لا يعتمد على نوع الغاز.
- يكون الضغط الجزئي لمول واحد من أى غاز عند درجة حرارة وضغط معينين هو نفسه.
- ماذا يحدث عند وضع 1mol من الهيليوم مع 1mol من النيتروجين في وعاء مغلق؟ لأنه لم يحدث تغيير في حجم كل من الغازين وعدد جسيماتها فإن الضغط الكلي يكون مساوياً لمجموع الضغط الجزئي لكل منهما.
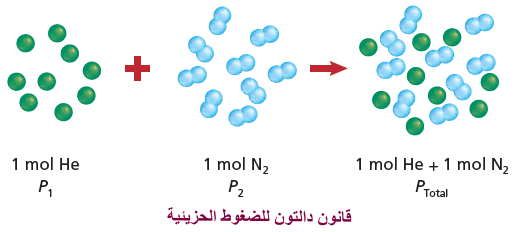
أهمية قانون دالتون
- تستخدم الضغوط الجزئية للغازات لتحديد كمية الغاز الناتجة عن التفاعل.
- التجربة التالية توضح أهمية قانون دالتون حيث يتفاعل حمض الكبريتك H2SO4 مع الخارصين Zn لإنتاج غاز الهيدروجين الذي يتم جمعه عند درجة حرارة 20Co

- حيث يُجمع الغاز الناتج فوق الماء في وعاء ماء منكس، كما هو موضح في الشكل التالي، فيحل الغاز محل الماء ويكون الغاز الناتج مزيجًا من غازي الهيدروجين وبخار الماء.
- وبهذا يكون الضغط الكلي داخل الوعاء يساوي مجموع الضغطين الجزئيين لكل من الهيدروجين وبخار الماء.
- ترتبط الضغوط الجزئية للغازات عند درجة الحرارة نفسها بتراكيز هذة الغازات.
- فالضغط الجزئي لبخار الماء له قيمة ثابتة عند درجة حرارة معينة. ويمكنك الحصول على هذه القيم بالرجوع إلى المصادر، فعلى سبيل المثال، الضغط الجزئي لبخار الماء عند درجة حرارة 20Co هو 2.3kPa
- ويمكنك حساب الضغط الجزئي لغاز الهيدروجين بطرح الضغط الجزئي لبخار الماء من الضغط الكلي.
تمرين: خليط من الغازات النبيلة تحتوي 4.46mol من غاز النيون (Ne) و 0.74mol من الارجون (Ar) و 2.15mol من الزينون (Xe) أحسب الضغط الجزئي لكل غاز علما بان الضغط الكلي يساوي 2atm ودرجة الحرارة ثابتة.
الحل:
اولاً : نجد عدد المولات الكلية:
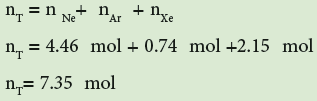
ثانياً : نجد الكسر المولي لكل غاز على حده:
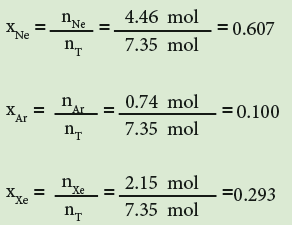
ثالثاً : نجد الآن الضغط الجزئي لكل غاز:
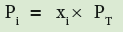
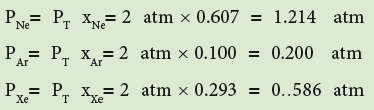
وللتأكد نجمع الضغوط الجزئية المفروض أنها = 2
1.214atm + 0.200atm + 0.586 atm = 2.000 atm