التهجين من نوع sp2
- ينتج هذا النوع من التهجين من مزج (دمج) مـجـال من نوع (s) مع مجالين من نوع (P) لنحصل على ثلاث مجالات مهجنة من نوع (sp2) وتتجه المجالات المهجنة إلى رؤوس مثلث متساوي الأضلاع في مستوى واحد والزاوية بين أي مجالين °120 .
- هذا النوع من التهجين يوجد في الجزيئات أو الأيونات التي حول ذرتها المركزية ثلاثة أزواج أو ثلاثة مجموعات من الأزواج الإلكترونية>
- ومن الأمثلة على هذا النوع من التهجين:
+BF3 & GaI3 & BI3 & SO3 & CH2O & CO32- & NO3- & CH3
كيف تتكون الرابطة التساهمية في BF3 من خلال مفهوم التهجين
(1) نكتب التركيب الإلكتروني لذرة البورون في الحالة المستقرة (المنفردة):
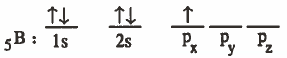
نلاحظ من التوزيع الإلكتروني أن البورون يحـتـوي على إلكتـرون منفرد ، وهذا يعني ان البورون يكون رابطة تسـاهـمـيـة واحـدة ، ولكن في الواقع البورون يرتبط بثلاث روابط تساهمية بين (B - F) ولتفسير ذلك يجب الحصول على إلكترونين منفردين إضافيين كما في الخطوة التالية.
(2) ينتقل (يستثار) إلكترون من المدار ( 2s ) إلى أحد مجالات (2p ) الفارغة عندما يكتسب طاقة ليصبح لدينا ثلاث إلكترونات منفردة .
ويكون التركيب الإلكتروني لذرة البورون في الحالة المثارة:
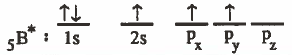
نلاحظ توفر ثلاث إلكترونات منفردة ، ولكن عندما يرتبط البورون مع الفلور يحدث نوعين من التداخل بين المجالات كـمـا يلي: ( 2s - 2p ) وكذلك بين ( 2p - 2p ) ينتج عن ذلك روابط غير متكافئة وهذا يناقض مـا هو معروف من أن الروابط بين (B- F) مـتـمـاثلة في القوة والطول ، ولتفسير ذلك يجب الحصول على ثلاث مجالات متماثلة كما يلي .
(3) تحـدث عـمـلـيـة دمج بين مـجـالـين من (p) والمجـال (2s) لينتج ثلاث مـجـالات مـهـجنة متساوية في الشكل والطاقة ويرمز لكل منهما (sp2)
ويكون التركيب الإلكتروني لذرة البورون في بعد التهجين:
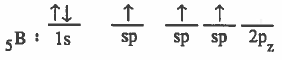
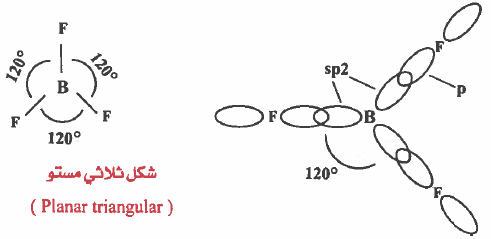
(4) يحدث تداخل بين أحد مجالات (2p) من ذرة الفلور ومجالات (sp2) المهجنة من ذرة البورون لتتكون ثلاث روابط تساهمية وهذه الروابط متساوية في الشكل والطاقة ولذلك فإن الزاوية FBF تكون (120o).
وحـيث ان المركب ينتمي إلى النوع (AX3) ، إذن الـشـكـل الهندسي للجزيء هو مثلث مستو (Planar triangular) . وهذا الشكل الهندسي هو الشكل الوحيد الذي يجعل الأزواج الإلكترونية أقل تنافراً .