الانتشار والتدفق
- وفقاً لنظرية الحركة الجزيئية ونظراً لأن المسافة كبيرة بين الجزيئات فإن قوي التجاذب بين جسيمات الغاز تكاد تكون منعدمة. ولهذا تنتشر هذة الجسيمات بسهولة ويكون المكان الذي ينتشر فية الغاز في كثير من الأحيان مشغولاً بغاز آخر وتسبب الحركة العشوائية لجسيمات الغازات باختلاط بعضهما ببعض، حتى يصبح توزيع الغازات المختلطة متساويًا.
- يصف الانتشار حركة تداخل المواد معاً وقد يكون هذا المصطلح حديثاً ولكن عملية الانتشار مألوفة لك لإانت تشم رائحة الطعام عند طهية في أرجاء المنزل كلها، بسبب انتشار جسيمات الغاز من منطقة ذات تركيز عال (وهي في هذه الحالة المطبخ) إلى منطقة ذات تركيز منخفض (باقي أرجاء المنزل).
- أما التدفق فهو عملية ذات صلة بالانتشار ويحدث التدفق عندما يخرج الغاز من خلال ثقب صغير. فما الذي يحدث مثلاً عند ثقب إطار سيارة أو بالون؟
- قام توماس جراهامفي عام 1846 م بإجراء تجربة لقياس معدل سرعة تدفق غازات مختلفة عند درجة الحرارة نفسها، وقد صمم تجربته بحيث تتدفق الغازات إلى مكان لا توجد فيه مادة. وقد اكتشف وجود علاقة عكسية بين معدل سرعة التدفق والكتلة المولية للغاز.
قانون الانتشار لجراهام Graham’s Law of Diffusion
- توصل جراهام من تجاربه المختلفه إلى إن: (نص القانون)
سرعة الانتشار للغازات النافذة خلال الثقوب الصغيرة تتناسب عكسياً مع الجذر التربيعي للكتلة المولية (M)

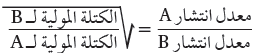
الكتلة المولية لغاز كلوريد الهيدروجين 36.5g/mol ولغاز الامونيا 17g/mol لذلك سرعة انتشار غاز الامونيا تكون أسرع من كلوريد الهيدروجين .
- كما توصل جراهام إيضاً إلى أن:
سرعة انتشار الغازات النافذة خلال ثقوب صغيرة تتناسب عكسياً مع الجذر التربيعي لكثافة الغاز .
- فاذا أعتبرنا سرعة نفاذ غازين من خلال نفس الثقوب هي r1 ، r2 وكانت كثافتيهما ρ1 و ρ2 على التوالي فانه وإعتماداً على قانون جراهام يكون:
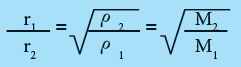
حيث M1 و M2 هي الكتل المولية للغازين على التوالي .
مثال توضيجي على قانون جراهام للانتشار
- بتطبيق القانون على انتشار غازي الهيدروجين والاوكسجين النافذة من خلال ثقب معين نتوصل الى:
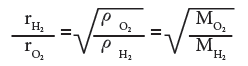
حيث rH2 و ρH2 و MH2 هي سرعة وكثافة والكتلة المولية لغاز الهيدروجين على الترتيب اما rO2 و ρO2 و MO2 هي الكميات المناظرة بالنسبة الى غاز الاوكسجين.
العلاقة بين الانتشار وزمن الانتشار
عندما ينتشر حجم معين من غاز فانه يستغرق زمناً معيناً وإن سرعة انتشار إي غاز في درجة حرارة وضغط معينين يتناسب عكسياً مع الزمن الذي تستغرقه عملية الانتشار لذلك الغاز أي كلما زادت السرعة قل الزمن اللازم للانتشار.
حيث ان t1 و t2 هي أزمان الانتشار للغاز الاول والثاني على التوالي. ويمكن جمع قوانين جراهام بقانون واحد على الصورة الاتية :
القانون الشامل لجراهام للانتشار
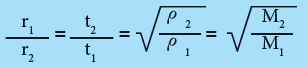
- هل تعلم ينتشر غاز البروم في هواء الاسطوانة الموجود فيها بعد تركه لعدة ساعات.
