الرابطة التساهمية
تتكون الرابطة التساهمية نتيجة مشاركة كل ذرة من الذرات بعدد من الإلكترونات يساوى العدد الذي تحتاجه لكي تكمل مستوى الطاقة الأخير بالإلكترونات ويصل كل منهم بالتركيب الإلكتروني لأقرب غاز خامل .
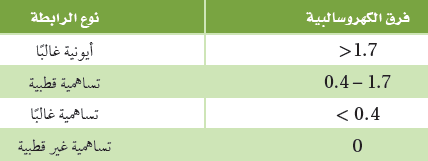
- يبين الجدول التالي إمكانية توقع نوع الرابطة باستعمال فرق الكهروسالبية بين العناصر المكونة للرابطة.
أنواع الروابط التساهمية
(أ) تصنيف يعتمد على رتبة الرابطة
وينقسم إلى ثلاثة أنواع هي :
(1) الرابطة الأحادية Single bond
- فيها تساهم الذرات المشاركة في تكوينها بإلكترون واحد من كل ذرة مما ينتج مشترك من الإلكترونات لكل ذرة وتسمى رابطة سيجما Sigma ويرمز لها بالرمز (σ)
(2) الرابطة الزوجية Double bond
تساهم كل ذرة مشتركة في تكوينها بإلكترونين مما ينتج عنه زوجين من الألكترونات وتتكون من رابطة (σ) ورابطة تسمى باى (pi) ويرمز لها بالرمز (π)
(3) الرابطة الثلاثية Triple bond
تساهم كل ذرة بثلاثة إلكترونات فينتج ثلاثة أزواج من الألكترونات وتتكون من رابطة (σ) ورابطتين (π)
(ب) تصنيف يعتمد على قطبية الرابطة
وينقسم إلى نوعين هما:
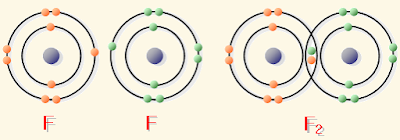
(1) رابطة تساهمية نقية Pure covalent bond
هي الرابطة التى تنشأ بين ذرتين متشابهين أو متقاربين جداً في قيم الكهروسالبية فتكون السحابة الإلكترونية موزعة بالتساوي بين الذرتين.
- من أمثلة الرابطة التساهمية القطبية: جزيء الأكسجين والكلور والنتروجين والهيدروجين و الفلور و البروم
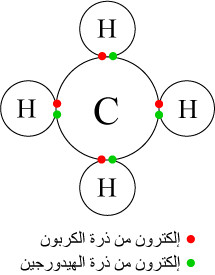
(2) رابطة تساهمية قطبية Polar Covalent bond
هي الرابطة التى تنشأ بين ذرتين مختلفين في قيم الكهروسالبية بمقدار أقل من (2) حيث يستقطب الذرة الأعلى كهروسالبية إلكترونات الرابطة نحوها فتحمل شحنة سالبة جزئياً (partial negative -δ) والذرة الأقل كهروسالبية تحمل شحنة موجبة جزئياً (partial positive +δ).
- أمثلة على الرابطة التساهمية القطبية : النشادر - الماء - فلوريد الهيدروجين - الميثان.
ملاحظات
(1) في الرابطة التساهمية يصبح زوج الإلكترونات المشترك جزء من الغلاف الخارجي للذرتين.
(2) الرابطة التساهمية هي السائدة في المركبات العضوية نظراً لتقارب كهروسالبية الكربون مع الهيدروجين والهالوجينات والأكسجين والنتيروجين.
قوة الروابط التساهمية The Strength of Covalent
- الرابطة التساهمية تتضمن قوي تجاذب وقوى تنافر وفي الجزئ تتجاذب النوى مع الألكترونات ، وتتنافر النوي مع النوى الأخرى ، كما تتنافر الإلكترونات مع الألكترونات الأخرى أيضاً.
- عندما يختل هذا التوازن بين قوى التجاذب والتنافر يمكن كسر الرابطة التساهمية.
- ولاختلاف الروابط التساهمية في قوتها يسهل كسر بعض الروابط أكثر من غيرها. وهناك عدة عوامل تؤثر في قوة الرابطة التساهمية.
طول الرابطة التساهمية The length of Covalent bond
- تعتمد قوة الرابطة التساهمية على المسافة بين النواتين .
- طول الرابطة هى المسافة بين نواتي الذرتين المرتبطتين بالرابطة التساهمية.
- تعتمد قوة الرابطة على طول الرابطة وقوة التجاذب بين الذرتين، ويحدد ذلك بحجم الذرتين المترابطتين وعدد أزواج الإلكترونات المشتركة.
- الجدول التالي يوضح قائمة بأطوال الروابط لجزيئات الفلور F2 والأكسجين O2 والنيتروجين N2.
- لاحظ كلما زاد عدد الألكترونات المشتركة قصرت الرابطة.
- طول الرابطة وقوتها مرتبطان أحدهما مع الآخر، فكلما قصر طول الرابطة كانت أقوى. فالرابطة الأحادية للفلور F2 أضعف من الرابطة الثنائية للأكسجين O2 ، وكذلك الرابطة الثنائية للأكسجين أضعف من الرابطة الثلاثية للنيتروجين.
