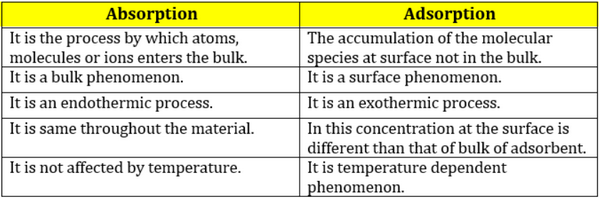
الأمتصاص Absorption
- الامتصاص هو ظاهرة فيزيائية أو كيميائية أو عملية تدخل فيها الذرات والجزيئات، والأيونات (الشوارد) في حجم جسم صلب أو مادة سائلة.
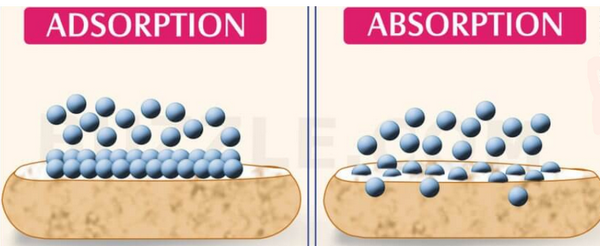
- وهي عملية تختلف عن الادمصاص أو الامتزاز ، لأن الجزيئات التي تخضع للامتصاص تدخل ضمن الحجم الكلي وليس على سطحه. فالامتصاص شمل الحجم الكلي للعامل الممتص Absorbing Agent.
الامتزاز (الادمصاص) Adsorption
- الادمصاص أو الامتزاز هو التصاق الجزيئات (أو الأيونات أو الذرات) بسطح جسم صلب أو سائل حيث تتراكم الجزيئات فقط على السطح ولا تدخل في حجم المادة الممتزة (المدمصة) Adsorbing Material.
تدعى المادة التي تُمتز جزيئاتها على السطح بالمادة التي تُمتز أو تُدمص Adsorbate، وتدعى المادة التي يجري على سطحها عملية الامتزاز، بالمادة المدمصة أو الممتزة Adsorbent. أما عملية الامتزاز فهي ظاهرة سطحية.
- يوجد نوعان من الأمتزاز : امتزاز طبيعي ، امتزاز كيميائي.
- الخلاصة أن ادلة الامتصاص تدخل داخل الجسم البلوري للراسب أما أدلة الأمتزاز تلتصق بسطح الراسب فقط ولا تداخل فى داخل الجسم البلوري للراسب.
- مقارنة بين الأدمصاص والأمتصاص باللغة الأنجليزية
أنواع الأمتزاز
يمكن تقسيم عملية الأمتزاز تبعاُ لطبيعة قوى التجاذب بين جزيئات الغاز الممتزة وسطح الماز إلى نوعين:
أولاُ/ الأمتزاز الفيزيائي (الطبيعي)
- عندما تكون الطبقة الممتزة مرتبطة بسطح الماز بقوى معينة تشبه تلك المسئولة عن إسالة الغازات أو قوى التماسك فى السائل (بين جزيئات السائل الواحد) تسمى هذة القوى بالقوى الفيزيائية أو قوى فاندرفال ويقال أنه إمتزاز فيزيائي.
أمثله على الامتزاز الفيزيائي: امتزاز غاز النيتروجين وغاز النشادر وغاز ثاني أكسيد الكربون على سطح الفحم النباتي.
خصائص الأمتزاز الفيزيائي
(1) صغر حرارة الأمتزاز تصل إلى حوالي 5000 سعر/مول.
(2) انعكاسي ويصل الاتزان بسرعة عندما تتغير الحرارة والضغط. فالغاز الممتز يمكن أن يترك سطح الماز وذلك بالتفريغ أو التسخين ولا تتغير جزيئات الغاز التى تركت سطح الماز (كيميائياً أو فيزيائياً).
(3) تزداد كمية الغاز الممتزة على السطح الماز كلما كان الغاز سهل الإسالة أى تسير في محاذاة درجة الحرارة الحرجة للغاز.
(4) الطبقات الممتزة فيزيائياُ يمكن أن يكون سمكها أكثر من جزئ واحد وتكون الطبقة الأولى مثبتة بقوة أكثر من الطبقات التى تليها ، ولكن قوى فاندرفال تكون متواجدة خارج كل طبقة ممتزة كما هو الحال عند سطح السوائل.
ثانياُ/ الامتزاز الكيميائي
- يشتمل الامتزاز الكيميائي على تكوين مركب كيميائي على سطح الصلب يسمى مركب السطح.
- يشتمل على تبادل أو مشاركة إلكترونية بين السطح الماز والجزئ أو الذرة الممتزة.
- فى بعض الأحيان يحدث انتقال كامل أي تفقد الذرة إلكتروناتها إلى السطح الماز ، وتتحول إلى أيون موجب ممتز على سطح الصلب). مثل امتزاز الصوديوم على سطح التنجستين
- وفى طريقة أخري يمكن للسطح الماز أن يفقد إلكتروناُ إلى الذرة الممتزة وبالتالي تتحول إلى أيون سالب مثل امتزاز غاز الأكسجين على سطح معظم المعادن
خصائص الامتزاز الكيميائي
(1) حرارة الأمتزاز تصل مابين 10.000 - 100.000 سعر/مول.
(2) غير انعكاسي بمعنى أن الطبقة الممتزة كيميائياُ من الصعب إزالتها، وغالياُ الغاز الذي يترك سطح الصلب مختلفاُ في تركيبة الكيميائي عن الغاز الممتز.
(3) لا توجد علاقة بين الأمتزاز الكيميائي وسهولة إسالة الغاز الممتز ، ولكنها لها علاقة بقابلية الغاز للإتحاد مع الصلب.
(4) يتم الإمتزاز الكيميائي عندما يتغطى سطح الصلب بطبقة واحدة من الغاز الممتز، ولكن وجد أنه يتم امتزاز فيزيائي فوق هذة الطبقة.
(5) الغاز الممتز فى الغالب يكون أكثر نشاطاُ من الغاز الحر ، ويكون هذا الغاز الممتز مسئولاً عن عمليات حفز مختلفة.
الفرق بين الأمتصاص والأمتزاز
يجري الامتصاص في درجات الحرارة العادية ببط ء ، وتزداد سرعة الامتصاص بارتفاع درجة الحرارة ويمكن تمييز الامتصاص عن الامتزاز من خلال المؤشرات التالية:
(1) الأمتصاص في مادة صلبة والذي ينتج عنه تكوين محلول حقيقي يكون عادة مصحوباً بإمتصاص حرارة، وبهذا يتميز الإمتصاص عن الأمتزاز الذي يكون عادة مصحوباُ بإنبعاث حرارة.
(2) عندما تكون كمية المادة المنتشرة في مادة اخري صغيرة ، أى عندما يكون تركيز المادة المنتشرة في المادة الثانية قريباُ من الصفر فأن كمية الغاز الممتص تتناسب طردياً مع الجذر التربيعي لزمن الامتصاص ، وتنطبق هذة العلاقة على الإمتزاز البطء فى ظروف خاصة.
(3) الأمتزاز البطئ لمادة على سطح مادة اخري يسير بسرعة تتوقف على اصطدامات جزيئات المادة التى تعاني الإمتزاز بالسطح ، وعندما تكون المادة الممتزة غازية فإن سرعة الأمتزاز البطئ تتناسب طردياُ مع ضغط الغاز.
أما سرعة الامتصاص الذي يؤدي إلى تكوين محلول فأنها تتقرر بدلالة تركيز المادة الممتزة على السطح بإعتبار أن الأمتزاز خطوة وسطية في عملية الإمتصاص.والمعروف ان تركيز المادة الممتزة لا تتوقف بالضرورة على ضغط المادة التى لم تبلغ بعد حالة الإمتزاز.
(4) يكون امتصاص الغازات البسيطة كالهيدروجين مصحوباً بتفكك جزيئات الغاز إلى ذرات وتحتل الذرات الناتجة المواقع البينية للهيكل البلوري للمادة الصلبة التي تمتص الغاز . وتتناسب كمية الغاز الذي يعاني الامتصاص عند الاتزان مع الجذر التربيعي لضغط الغاز، وهذه العلاقة نادراً ما تصدق على الامتزاز وتحتل الذرات الناتجة المواقع البينية للهيكل البلوري للمادة الصلبة التي تمتص الغاز .
(5) تخضع أنواع خاصة من الانتشار لقانون فك Fick's Iaw ولذا فالعملية لا تتطلب طاقة تنشيط . وتتناسب سرعة الانتشار مع الجذر التربيعي لدرجة الحرارة المطلقة . أما الامتزاز البطيء فإنه يحتاج إلى طاقة تنشيط، وتتغير سرعة هذا النوع من الامتزاز أسياً مع درجة الحرارة المطلقة .
(6) عندما يؤدي امتصاص غاز في مادة صلبة إلى تكوين مركب فإن عملية الامتصاص تستهلك كمية كبيرة من الغاز، وهذه الكمية تزيد كثيراُ على الكمية التي يمكن امتزازها من قبل المادة الصلبة عند نفس الظروف .
فالهيدروجين يعاني امتصاصاً في فلزات البلاديوم والزركونيوم والتيتانيوم مع تكوين هيدريدات هذه الفلزات، ولذا فإن كمية الامتصاص تكون محسوسة .
مراجع ومصادر مهمة عن الأمتزاز والأمتصاص بالتفصيل
(1) كتاب أساسيات الكيمياء الفيزيائية تأليف/ حسن أحمد شحاتة الفصل التاسع ص303
(2) كتاب أسس كيمياء السطوح تأيف / محمد مجدى واصل