نظرية الأوربتالات الجزيئية Molecular Orbital Theory
- تعرف أيضاً بنظرية المدرات الجزيئية أو نظرية الأفلاك الجزيئية ويرمز لها بالرمز MOT أو MO theory.
- نظرية رابطة التكافؤ Valence Bond Theory أعتبرت أن الجزئ مجرد ذرتين أو اكثر حدث تداخل بين أوربتالاتها الذرية لتكوين الروابط التساهمية بين هذة الذرات. وتبقي بقية الأوربتالات الذرية التى لم تشارك في تكوين الروابط بحالاتها كما هي فى الذرة المفردة.
- جاءت نظرية الاوربتالات الجزيئية واعتبرت أن الجزئ كوحدة واحدة أو ذرة كبيرة متعددة الانوية يحدث تداخل بين جميع الأوربتالات الذرية لتكوين أوربتالات جزيئية.
- كما يرمز للأوربتالات الذرية بالرموز S , P , d , f يرمز للأوربتالات الجزيئية بالرموز σ , π , δ سيجما وباي ودلتا.
الأفلاك الجزيئية الرابطة والغير رابطة Bonding and anti boning Molecular orbitals
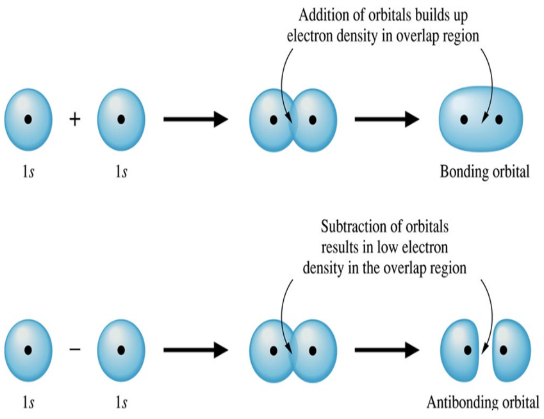
- من وجهة النظر الرياضية فإن اتحاد المدارات الذرية لتكوين المدارات الجزيئية يتضمن جمع أو طرح الدوال الموجية لهذه المدارات .
أولاً/ جمع الدوال الموجية :
- ينتج عنه مدارات جزيئية رابطة (Bonding) .
- تكون المنطقة ذات الكثافة الإلأكترونية العالية هي المنطقة بين النواتين .
- الشحنة الإلكترونية بين النواتين تنتشر على منطقة أكبر منها في حالة المدارات الذرية
- طاقة المدار الجزيئي أقل من طاقة المدار الذري بسبب انخفاض التنافر الإلكتروني.
- المدارات الجزيئية الرابطة أكثر استقراراً من المدارات الذرية .
ثانياُ/ طرح الدوال الموجية
- ينتج عن طرح الدوال الموجية للمدارات الذرية مدارات جزيئية مضادة للربط ( antibonding*) .
- في منطقة العقدة بين النواتين تكون الكثافة الإلكترونية صغيرة جداً تقريباً (zero).
- وبذلك فإن الإلكترونات لا تحجب إحدى النواتين من الإخرى وهذا يؤدي إلى زيادة التنافر بين النواتين .
- وعلى ذلك فإن المدارات الجزيئية مضادة للربط لها طاقة أعلى من طاقة المدارات الذرية .
- عندما تشغل المدارات المضادة للربط بالإلكترونات فإن الجزئ يكون أقل استقراراً منه في حالة كون هذه المدارات لم تشغل بالإلكترونات .
ملاحظات هامة
(1) كما هو واضح من الأسم (رابط ، ومضاد للربط) فأن وضع إلكترونات في فلك جزيئي رابط سوف يعطي رابطة تساهمية ثابتة. فى حين ينتج وضع إلكترونات في فلك مضاد للربط رابطة غير ثابتة.
(2) فى الأفلاك الجزيئية الرابطة تكون كثافة الإلكترون أعلى مايمكن بين نواتي ذرتي الرابطة ، فى حين تقل الكثافة الألكترونية في الأفلاك الجزيئية المضادة للرابط إلى الصفر بين النواتين.
تداخل الأفلاك الذرية حسب نظرية الأفلاك الجزيئية.
أولاً/ تداخل أفلاك (s) مع بعضها
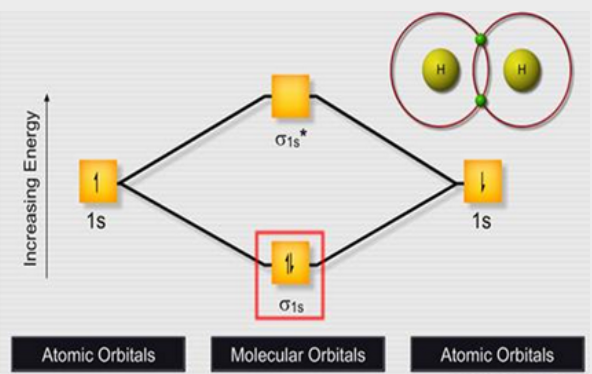
- نتيجة تداخل أوربتال ذري (1s) لذرة هيدروجين مع أوربتال ذري (1s) لذرة هيدروجين أخري ينتج:
- أوربتال جزيئي رابط Bonding يسمى σ1s (نتيجة جمع الدوال الموجية)
- أوربتال جزيئي مضاد للربط anti-bonding يسمى *σ1s ( نتيجة طرح الدوال الموجية) كما بالشكل التالي:
ويرسم الترابط فى الجزئ على الصورة التالية
ثأنياُ: تداخل أفلاك (P) مع بعضها
الأوربتالات 2p يمكن أن تتداخل بطريقتين:
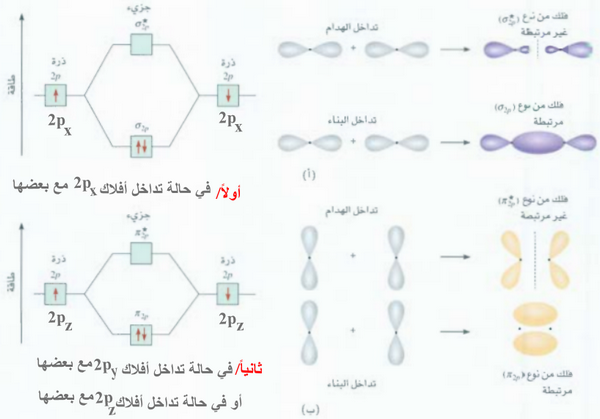
(1) يتداخل Px مع Px دائماُ بالرأس وتتكون أوربتالات جزيئية رابطة σ2px ومضادة للربط σ*2px
(2) يتداخل Py مع Py دائماُ بالجنب وتتكون أوربتالات جزيئية رابطة π2py ومضادة للربط π*2py
(3) يتداخل Pz مع Pz دائماُ بالجنب وتتكون أوربتالات جزيئية رابطة π2pz ومضادة للربط π*2pz
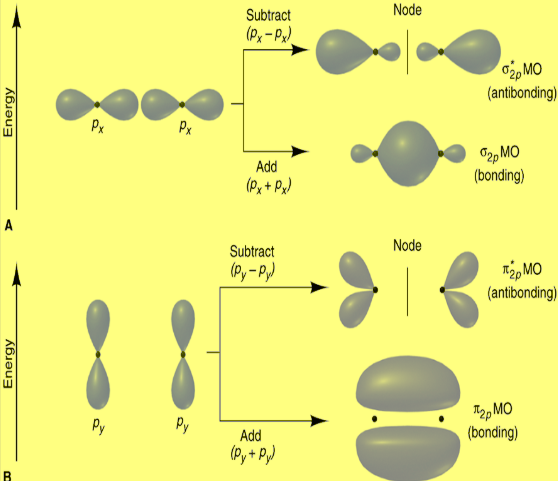
ويمكن تمثلها كالتالي:
قواعد تحديد بناء الأفلاك الجزيئية والثباتية
- لكتابة البناء الإلكتروني لجزي يجب أولاً ترتيب الأفلاك الجزيئية بحسب الزيادة فى الطاقة ، ثم تستخدم القواعد الأرشادية التالية لملء الأفلاك الجزيئية بالإلكترونات:
(1) عدد الافلاك الجزيئية المتكونة = عدد الأفلاك الذرية المتحدة نفسها.
(2) كلما كانت الأفلاك الجزيئية الرابطة أكثر ثباتاُ ، كانت الأفلاك الجزيئية المضادة للربط من النوع نفسة أقل ثباتاً.
(3) يبدأ مل الأفلاك الجزيئية من الأقل إلى الأعلى فى الطاقة ، وفى الجزئ الثابت يكون عدد الألكترونات في الأفلاك الرابطة أعلى من عدد الألكترونات في الأفلاك المضادة للربط دائماً وذلك لاننا نضع الالكترونات اولاً في الافلاك الجزيئية الرابطة الاقل فى الطاقة.
(4) كما هو فى الافلاك الذرية فأن كل فلك جزيئي يمكن ان يحتوى على إلكترونين بحد أقصى ، ويكون غزلهما متعاكساُ كي ينسجم مع مبدأ باولي فى الأستبعاد.
(5) عند إضافة إلكترونات إلى أفلاك جزيئية متساوية فى الطاقة فأن التوزيع الإلكتروني يتبع قاعدة هوند وتكون الألكترونات في هذة الأفلاك متماثلة الغزل.
(6) عدد الألكترونات فى الافلاك الجزيئية = مجموع عدد الألكترونات فى الذرات الرابطة.
مراجع هامة لشرح نظرية الأوربتالات الجزيئية MOT
(1) كتاب المفاهيم الأساسية فى الكيمياء العامة الباب العاشر/ الروابط - نظرية الأفلاك الجزيئية.
(2) كتاب Chemistry Raymond Chang 10e الفصل العاشر / Chemical Bonding
(3) روابط مهمة لشرح رائع من موقع / Read Chemistry
Molecular Orbital Theory
Molecular Orbitals for Homonuclear Diatomic Molecules
Molecular Orbitals for Heteronuclear Diatomic Molecules