النظائر Isotopes
- النظائر هى ذرات تحتوى على نفس العدد من البروتونات وتختلف فيما بينها فى عدد النيترونات.
- النظائر هي ذرات لها نفس العدد الذري وتختلف فى العدد الكتلي.
- تعنى كلمة (نظير) أى المكان نفسه أى أن النظائر للعنصر الواحد تحتل نفس المكان فى الجدول الدوري.
- أن العناصر فى الطبيعه تنقسم إلى نوعين : نوع له نظائر ونوع ليس له نظائر.
أمثلة على النظائر
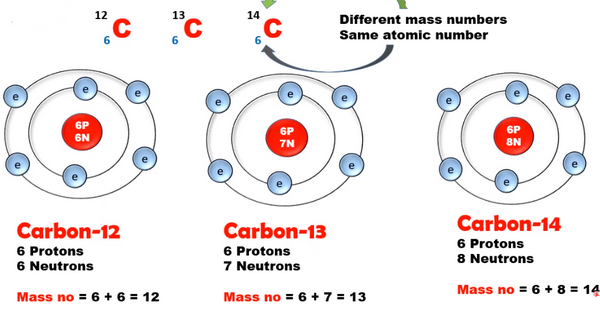
(1) نظائر عنصر الكربون
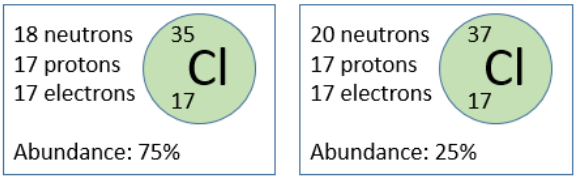
(2) نظائر عنصر الكلور
(3) نظائر عنصر الهيدروجين

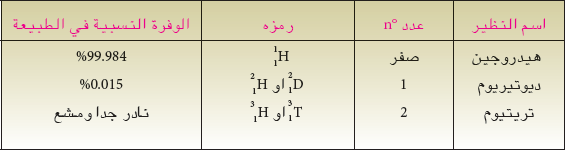
- تتواجد معظم ذرات الهيدروجين في الماءعلى هيئة H2O إلا اننا نجد ان بين كل 6000 جزيء ماء عادي جزيء واحد فقط على هيئة (D2O) (ماء ثقيل) ، ويتم الحصول على الماء الثقيل باستخدام التحليل الكهربائي للماء العادي حيث يتحرر الهيدروجين العادي من الماء بسهولة أكثر من الهيدروجين الثقيل D21 وباستمرار التحليل الكهربائي للماء يزداد تركيز D2O الذي يفاد منه في مجالات عديدة منها كمهدئ للمفاعلات النووية لتوليد الطاقة الكهربائية.
نظائر العنصر الواحد لها نفس الخواص الكيميائية
- نظائر العنصر الواحد تكون متماثلة فى خواصها الكيميائية لأن النظائر لها نفس العدد من الالكترونات ونفس العدد من البروتونات أي العدد الذري نفسه فهي متماثلة في خواصها الكيميائية لان عدد الالكترونات يحدد الخواص الكيميائية للذرة.
نظائر العنصر الواحد مختلفة فى الخواص النووية
اختلاف النظائر في عدد الكتلة أي تختلف في مجموع عدد النيوترونات وعدد البروتونات فيؤدي الى اختلاف في خواصها النووية لأنهما يحددان الخواص النووية للنواة.
حساب الكتلة الذرية للعنصر
- تتوافر معظم العناصر بشكل خليط من نظيرين او اكثر وتختلف نسب وجود هذه النظائر للعنصر الواحد والتي يعبر عنها (الوفرة الطبيعية النسبية لكل نظير).
- الكتلة الذرية (Atomic mass) لأى عنصر وهي تعبير عن متوسط اعداد الكتلة لنظائر العنصر الواحد مضروباً في وفرتها النسبية في الطبيعة، وتقاس بوحدة كتلة ذرية (atomic mass unit) واختصارها (amu) وتساوي:
1amu =1.66 x 10-24 g
- يمكن حساب الكتلة الذرية من نسب الوفرة الطبيعية لنظائر العنصر الواحد باستخدام العلاقة الاتية :

مثال : حساب الكتلة الذرية لعنصر الماغنسيوم
يتكون عنصر المغنسيوم من ثلاث نظائر طبيعية، الأوزان الذرية والنسبة المئوية لوفرة هذه النظائر موضحة بالجدول التالي.
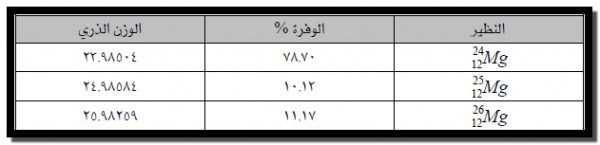
الوزن الذري = الوفرة % × الوزن الذري للنظير الأول + الوفرة % × الوزن الذري للنظير الثاني + الوفرة % × الوزن الذري للنظير الثالث
٢٥٫٩٨٢٥٩ × ٠٫١١١٧ + ٢٤٫٩٨٥٨٤× ٠٫١٠١٣ + ٢٣٫٩٨٥٠٤× ٠٫٧٨٧٠ =
٢٫٩٠٢ + ٢٫٥٣١ + ١٨٫٨٨ =
amu ٢٤٫٣١٣ =
- الجدول التالي يبين اعداد الكتلة لنظائر بعض العناصر

تطبيقات النظائر Application of Isotopes
أولاً: فى الطب
- يستخدم نظير الكوبلت 60Co في معالجة الأورام السرطانية.
- يستخدم نظير اليود 131I في معالجة تضخم الغدة الدرقية.
ثانياُ/ في الجيولوجيا
- استخدم العلماء نظائر اليورانيوم 235U و 238U والثوريوم Th232 لمعرفة وتقدير أعمار الصخور والنيازك والمتحجرات.
ثالثاُ/ في الصناعة
- تستعمل النظائر المشعة في المجال الصناعي وفي صناعة اجهزة السيطرة كاجهزة قياس سمك الصفائح أو تدفق السوائل والغازات.
- تستعمل في تشخيص مواقع تسرب السوائل والغازات الخطرة في الخزانات والانابيب وتسرب مياه الشرب تحت الارض دون حفرها.
رابعاُ/ فى الزراعة
- في المجال الزراعي تستخدم النظائر المشعة في ابحاث خصوبة التربة والاسمدة.
روابط هامة لشرح موضوع النظائر بالكامل من موقع Read Chemistry
(1) ?What are isotopes
(2) Identification of Isotopes
(3) Separation of Isotopes
(4) Examples of isotopes
(5) Isotopic effects
(6) Difference between Isotopes, Isobars and Isotones
(7) MCQ on Chapter: Isotopes, Isobars and Isotones
(8) Atomic Number, Mass Number, and Isotopes